

 |
zurück |  |
5 Untersuchung auf Hemmstoffe in Muskulatur, Niere und Leber
5.1 Zweck und Anwendungsbereich
Die Methode beschreibt ein mikrobiologisches Verfahren zum Nachweis antibakteriell wirksamer Stoffe (Hemmstoffe) in Muskulatur und Niere, bei Geflügel in Muskulatur und Leber. Die Untersuchung auf Hemmstoffe mit dem hier beschriebenen Verfahren kann ein "positives", "negatives" oder "zweifelhaftes" Ergebnis erbringen. Beim Nachweis des Vorhandenseins eines Hemmstoffes ist dessen Identifizierung oder Quantifizierung nur eingeschränkt möglich.
5.2 Kurzbeschreibung
Proben von Muskulatur, Nieren- oder Lebergewebe werden auf einen festen Nährboden gelegt, der eine hemmstoffempfindliche Bakterienkultur in bestimmter Konzentration enthält. Hemmstoffe Diffundieren während der Bebrütung des Testsystems in den Nährboden und verursachen in der Umgebung der Proben eine Wachstumshemmung. Die Größe des Hemmhofes ist ein Maß für den Hemmeffekt.
Stark keimhaltiges, gefrorenes oder erkennbar zersetztes Untersuchungsmaterial ist für die Untersuchung auf Hemmstoffe ungeeignet.
5.3 Chemikalien
5.3.1 Nährboden
Zur Nährbodenherstellung wird ein Trockennährboden folgender Zusammensetzung verwendet:
| 3,45 | g | Fleischpepton 10 |
| 3,45 | g | Caseinpepton 11 |
| 5,1 | g | NaCl |
| 13,0 | g | Agar |
| 1000 | ml | Aqua dest. |
Der Trockennährboden ist in frisch destilliertem oder voll entsalztem Wasser aufzulösen, zur Pufferung ist 0,1 % Kaliumdihydrogenphosphat (KH2PO4) hinzuzufügen. Für den Dreiplattentest sind Nährböden mit pH-Werten von .6,0, 7,2 und 8,0 herzustellen. Die Einstellung des pH-Wertes hat mit 0,1 N HC1 oder mit 0,1 N NaOH zu erfolgen. Der pH-Wert des fertigen Nährbodens ist nach dem Autoklavieren zu überprüfen.
Zur Vorbereitung des Nährbodens für den Hemmstofftest werden 500 ml des verflüssigten und auf +50 °C abgekühlten fertigen Nährbodens mit 0,5 ml einer Sporensuspension nach Nummer 5.4.1.1 unter Schütteln gleichmäßig vermischt. Dem auf einen pH-Wert von 7,2 eingestellten Nährboden werden außerdem 0,5 ml der in Nummer 5.3.2 genannten Gebrauchslösung von Trimethoprim zugesetzt und durch Schütteln mit dem Nährboden gleichmäßig vermischt. Das Gemisch wird so in Petrischalen ausgegossen, dass nach dem Erstarren eine gleichmäßige Schichtdicke von 2 mm vorhanden ist. Nach dem Erstarren des Nährbodens sind die Petrischalen unverzüglich auf 3 bis 50 c zu kühlen und bis zur Benutzung bei dieser Temperatur zu lagern. Die vorbereiteten Testplatten sollten innerhalb von drei Tagen nach der Herstellung verwendet worden sein.
5.3.2 Trimethoprimlösung
10 mg Trimethoprim (TMP) werden in 10 ml Ethanol unter Schütteln bei 50 °C gelöst (Stammlösung). Diese Lösung ist bei kühler und dunkler Aufbewahrung mehrere Monate haltbar. Durch Zugabe von 190 ml sterilem Aqua dest. wird die Lösung auf eine Konzentration von 50 µg Trimethoprim/ml eingestellt (Gebrauchslösung). Die Haltbarkeit dieser Lösung beträgt bei Kühllagerung mindestens 14 Tage.
5.4 Testkeim und Testblättchen
5.4.1 Testkeim
Als Testkeim ist Bacillus subtilis BGa zu verwenden. Er ist vom Bundesinstitut für gesundheitlichen Verbraucherschutz und Veterinärmedizin, Postfach 33 00 13, 14191 Berlin, oder vom Fachhandel zu beziehen.
Die abgebenden Stellen haben Wachstumseigenschaften und Resistenzverhalten des Testkeims gegenüber verschiedenen antimikrobiell wirksamen Stoffen regelmäßig zu überprüfen. Hierfür ist eine Kontrolle nach Nummer 5.4.1.2 vorzunehmen.
5.4.1.1 Sporensuspension
Die Sporensuspension kann in den Untersuchungsstellen hergestellt oder gebrauchsfertig vom Fachhandel bezogen werden. Zur Herstellung der Sporensuspension wird ein Nährboden mit der in Nummer 5.3.1 genannten Zusammensetzung auf einen pH-Wert von 7,0 ± 0,2 eingestellt und nach massiver Ösenbeimpfung oder durch Oberschichten mit 1 ml einer Keimsuspension mit dem in Nummer 5.4.3 genannten Testkeim 10 Tage bei 30 °C bebrütet. Danach wird der Testkeim mit steriler physiologischer NaCl-Lösung abgeschwemmt. Die Abschwemmung wird 10 Minuten bei 3000 U/ min zentrifugiert; anschließend wird der Überstand abgegossen, dem Sediment nochmals sterile physiologische NaCl-Lösung zugegeben und abermals 10 Minuten bei 3000 U/min zentrifugiert. Nach erneutem Abgießen des Überstands wird sterile physiologische NaCl-Lösung zugegeben und die Suspension 30 Minuten bei 70 °C erhitzt. Die so gewonnene Sporensuspension wird auf eine Dichte von ca. 107 Sporen/ml eingestellt (Gebrauchssporensuspension). Sie ist bei Kühlschranktemperatur (3 bis 5 °C) mehrere Wochen haltbar. Die Überprüfung der Dichte erfolgt als kulturelle Keimzählung im Oberflächenverfahren auf dem nach Satz 2 hergestellten Nährboden. Wird zur Herstellung der Suspension eine Bakterienkultur verwendet, die in der Untersuchungsstelle über mehrfache Passagen kultiviert worden ist, so ist spätestens nach jeder fünften Passage eine Überprüfung nach Nummer 5.4.1.2 vorzunehmen. Ist dies nicht möglich, ist eine neue Kultur des Testkeimes von den in Nummer 5.4.3 genannten Stellen zu verwenden.
5.4.1.2 Sensibilitätsprüfung und Identitätsprüfung des zu verwendenden Testkeimes
Bei mehrfachen Subkultivierungen von Bac. subtilis BGa ist eine Sensibilitäts- und Identitätsprüfung des Teststammes durchzuführen. Vor einer Identifizierung ist in jedem Fall zu prüfen, ob eine Reinkultur vorliegt.
5.4.1.2.1 Sensibilitätsprüfung des Testkeimes
Zur Sensibilitätsprüfung des verwendeten Testkeim-Stammes werden Testblättchen mit den in der Tabelle 1 angegebenen Wirkstoffen getränkt und auf einen vorbereiteten Nährboden gelegt. Die Hemmzonen eines sensiblen Teststammes liegen im angegebenen Bereich.
Tabelle 1: Wirkstoffe zur Sensibilitätsprüfung von Bac. subtilis BGA
| Wirkstoff | aufzutragende Menge/Testblättchen | Einsatz auf Testplatte [pH] | Hemmhof |
| Penicillin G | 0,01 IE | 6,0 | 5 - 10 mm |
| Sulfadimidin | 0,5 µg | 7,2 * | 9 -14 mm |
| Dihydrostreptomycin | 0,5 µg | 8,0 | 5 - 10 mm |
| Furazolidon | 1 µg | 6,0 | 9 - 11 mm |
| Chlortetracyclin | 0,01 µg | 6,0 | 7 - 9 mm |
| Erythromycin | 0,1 µg | 8,0 | 7 - 9 mm |
| Spiramycin | 1 µg | 8,0 | 7 - 9 mm |
| Enrofloxacin | 0,1 µg | 8,0 | 8 - 10 mm |
|
* mit Zusatz von Trimethoprim (vgl. Nummer 5.3.2) |
|||
5.4.1.2.2 Identitätsprüfung des Testkeimes
Zur Identitätsprüfung des verwendeten Testkeim-Stammes können ausgewählte Tests für die biochemische Differenzierung von Mikroorganismen der Gattung Bacillus herangezogen werden (Tabelle 2). Zellen aus einer 18 bis 24 Stunden alten Kultur von Bac. subtilis BGa sind beweglich; im Grampräparat sind ovale Sporen mit nicht angeschwollenen Mutterzellen zu sehen.
Tabelle 2: Identitätsprüfung von Bac. subtilis BGa durch ausgewählte biochemische Tests
| Test | Bewertung nach [Tagen] | Bemerkungen bzw. Zugabe weiterer Reagenzien | Auswertung (positives Ergebnis bei) | Biochem. Eigenschaften von Bac. subtilis BGA |
| Voges-Proskauer-Reaktion | 1, 3, 7 | zu 0,5 mL Bakteriensuspension 0,3 mL ± - Naphthol und 1 mL KOH | Rotfärbung | + |
| Citratverwertung | 14 | Schrägagar | Rotfärbung | + |
| Wachstum bei 60 °C und 65 °C | 3 | Flüssigkultur bei 60 °C vorwärmen | Trübung | Ø |
| Gasbildung aus Glucose | 7, 14 | Einsatz eines Durham-Röhrchens | Gasbildung im Durham-Röhrchen | Ø |
| Indolbildung | max. 14 | zu 0,5 mL ein Tropfen Kovacs-Reagenz | roter Ring auf der Oberfläche | Ø |
| Lecithinasebildung | 1, 3, 7 | Eigelb Nähragar | Ringbildung auf der Oberfläche | Ø |
| Anaerobes Wachstum | 3, 7 | Wachstum | Ø | |
| Wachstum in 7 % NaCl | 7, 14 | Bouillon schräg bebrüten | Trübung | + |
| Stärkehydrolyse | 3, 5 | Lugol'sche Lösung (20 %) auf den Agar fluten | farbige Zone um die Kolonie | + |
| Kaseinhydrolyse | max. 7 | Casein-Milchagar | klare Zone um die Kolonie | + |
5.4.2 Testblättchen
Als Testblättchen werden handelsübliche Erzeugnisse mit einem Durchmesser von etwa 6 mm, beladen mit 0,01 IE Penicillin G (für Nährboden pH 6,0), 0,5 µg Streptomycin (für Nährboden pH 8,0) oder 0,5 µg Sulfadimidin (für Nährboden pH 7,2), eingesetzt. Stehen gebrauchsfertig≪ Blättchen nicht zur Verfügung, können Blättchen aus Schleicher & Schüll-Papier Nr. 2628 selbst hergestellt und beladen werden.
5.5 Geräte und Hilfsmittel
5.5.1 Probenstanzgerät, Pinzette, Schere;
5.5.2 Lupe, besser Stereomikroskop, mit einer Einrichtung zur Hemmhofausmessung;
5.5.3 Brutschrank, 30 °C ± 1 °C.
5.6 Probenahme
Bei der Untersuchung auf Hemmstoffe können die nach Nummer 4.2.1 für eine Bakteriologische Untersuchung entnommenen Proben verwendet werden. Anderenfalls sind zu entnehmen:
5.6.1 aus einem Vorder- oder Hinterviertel eines geschlachteten Tieres möglichst ein ganzer, von Faszien umschlossener Muskelbauch oder ersatzweise ein Muskelwürfel von etwa 6 cm Seitenlänge.
Von der Entnahme und Untersuchung einer Muskelprobe von in § 1 Abs. 1 FlHG genannten Schlachttieren kann auf Antrag des Verfügungsberechtigten zunächst abgesehen werden; Entnahme und Untersuchung sind jedoch nachzuholen, wenn die Untersuchung auf Hemmstoffe in der Niere ein zweifelhaftes oder positives Ergebnis hatte;
5.6.2 eine Niere oder bei Geflügel die Leber.
5.6.3 Entnahme und Transport der Proben sind nach Nummer 4.2.3 vorzunehmen.
5.7 Durchführung
Aus der Muskulatur sowie aus dem Nierenmark oder der Leber sind je drei zylinderförmige Gewebestücke mit einem Durchmesser von 8 mm und einer Höhe von etwa 2 mm auszustanzen. Je ein Gewebestück der Niere oder der Leber und der Muskulatur sind auf je einen vorbereiteten Nährboden von pH = 6,0, pH = 8,0 und pH = 7,2 (letzterer mit Trimethoprimzusatz) aufzulegen. Die mit den Proben beschickten Testplatten sowie die mit Testblättchen nach Nummer 5.4.2 beschickten Kontrollplatten sind 18 bis 24 Stunden bei 30 °C ± 1 °C zu bebrüten.
5.8 Auswertung
Vor der Auswertung der mit den Proben beschickten Testplatten sind zunächst die Kontrollplatten zu prüfen. Die weitere Auswertung kann nur vorgenommen werden, wenn die gleichzeitig angesetzten Kontrollplatten einwandfreie Hemmzonen zeigen, deren Breiten den Angaben in Tabelle 1 entsprechen. Die Hemmzonenbreite zwischen dem Rand eines Gewebezylinders und der Wachstumsgrenze des Testkeimes wird ausgemessen. In Zweifelsfällen hat dies unter Zuhilfenahme einer Lupe oder eines Mikroskops zu geschehen. Eine vollständige Wachstumshemmung mit einer auf der Nährbodenoberfläche durchgehenden Hemmzone von mindestens 2 mm ist als positiv, eine solche von weniger als 2 mm, aber mehr als mindestens 1 mm, als zweifelhaft anzusehen.
5.9 Eintragung und Mitteilung des Ergebnisses der Untersuchung auf Hemmstoffe
5.9.1 Nach abgeschlossener Untersuchung auf Hemmstoffe sind durch die Untersuchungsstelle die vorgesehenen Abschnitte des Antragsvordrucks (siehe Muster nach Nummer 4.10) auszufüllen. Hierbei ist zum Ausdruck zu bringen, ob das Ergebnis der Untersuchung positiv, negativ oder zweifelhaft ist. Der ausgefüllte Vordruck ist mindestens drei Jahre aufzubewahren.
5.9.2 Die Untersuchungsstelle hat das Ergebnis der Untersuchung auf Hemmstoffe auf dem schnellsten Wege (z.B. fernmündlich, telegrafisch, mit Fernschreiber, Telefax oder anderen Mitteln der elektronischen Datenübertragung) und außerdem schriftlich der im Antragsvordruck bezeichneten Stelle mitzuteilen. Dies gilt insbesondere, wenn nach Nummer 5.6.1, Satz 2, zunächst auf die Entnahme einer Muskelprobe verzichtet worden ist. Sofern ein starker Keimgehalt, ein Gefrierprozess oder fortgeschrittene Zersetzungsprozesse einzelner Proben die Untersuchung auf Hemmstoffe oder deren Auswertung unmöglich gemacht haben, ist der Einsender darauf hinzuweisen.
6 Messung des pH-Wertes in Tierkörpern
6.1 Zweck und Anwendungsbereich
Ein erheblich abweichender pH-Wert erlaubt Aussagen über die Haltbarkeit des Fleisches. Zur Beurteilung einer abweichenden Fleischbeschaffenheit sind auch die Ergebnisse anderer Untersuchungen (z.B. Kochproben, Prüfung des Wasserbindungsvermögens) heranzuziehen. Die unter Nummer 6.4 genannten Richtwerte allein reichen nicht zur Beurteilung einer abweichenden Fleischreifung aus.
Diese Methode beschreibt ein Verfahren zur Messung des pH-Wertes in Tierkörpern von Schlachttieren - außer von Geflügel - und erlegtem Haarwild. Ihr liegt die Methode L 06.00-2 "Messung des pH-Wertes in Fleisch und Fleischerzeugnissen" der Amtlichen Sammlung von Untersuchungsverfahren nach § 35 LMBG zugrunde. Ergänzend zu dieser Methode ist bei der Messung in Tierkörpern folgendes zu beachten:
6.2 Meßstellen und Messung
Der pH-Wert wird
6.2.1 Vorbereitung der Meßstellen
Vor Einstich der Meßelektrode ist ggf. - insbesondere bei Zugang von der Körperoberfläche her und bei stark gekühlten Schlachtkörpern - mit einem geeigneten Instrument (Dorn, Messer) vorzustechen. Zur Messung des pH-Wertes im M. semimembranosus bzw. im M. adductor ist ein Teil dieses Muskels freizulegen, um die Meßelektrode einzuführen.
6.2.2 Messung
6.2.2.1 Die Elektroden werden in den Muskel eingestochen. Dabei ist darauf zu achten, dass ein einwandfreier Kontakt (Glasmembran und Diaphragma) mit dem Muskelfleisch hergestellt ist und die Elektrodenspitze stets nach unten zeigt, damit der Kontakt des Elektrolyts mit der Glasmembran erhalten bleibt. Luftblasen in der Elektrodenspitze sind durch vorsichtiges Schütteln zu entfernen. Das Temperaturpotentiometer des pH-Meßgerätes wird auf die Temperatur des Fleisches eingestellt. Nach Erreichen der Anzeigekonstanz wird der pH-Wert mit zwei Stellen nach dem Komma abgelesen. Die Messung wird an derselben Stelle wiederholt. Die Messung wird zunächst an einer Schlachthälfte vorgenommen. Im Verdachtsfall ist die andere Hälfte auf die gleiche Weise zu untersuchen.
6.2.2.2 Zur Ermittlung einer abnormen Fleischsäuerung (siehe Nummer 6.4) sind Messungen vorzunehmen
6.3 Auswertung
Aus den ermittelten Messwerten wird der arithmetische Mittelwert gebildet. Der pH-Wert wird auf eine Stelle nach dem Komma gerundet angegeben.
6.4 Richtwerte für abnorme Fleischsäuerung
6.4.1 beschleunigte Glykolyse liegt vor, wenn als Meßwert pH1
ermittelt wird;
6.4.2 verzögerte oder unvollständige Glykolyse liegt vor, wenn als Meßwert pHULT
ermittelt wird.
7 Bestimmung der auspressbaren Gewebeflüssigkeit aus Muskelproben
7.1 Zweck und Anwendungsbereich
Mit einem definierten Druckverfahren wird die Menge der austretenden Gewebeflüssigkeit, die mit standardisiertem Filterpapier aufgefangen wird, festgestellt. Eine große auspressbare Flüssigkeitsmenge weist auf eine geringe Wasserbindung des Fleisches von Schlachttieren - außer von Geflügel - hin; darüber hinaus kann der Grad der Ausblutung beurteilt werden.
Zur Beurteilung einer abweichenden Fleischbeschaffenheit sind auch die Ergebnisse anderer Untersuchungen (z.B. Kochproben, pH-Wert-Messung) heranzuziehen.
7.2 Geräte und Hilfsmittel
7.2.1 Plexiglaskompressorium mit Druckhebelmechanismus ("Braunschweiger Gerät"). Es besteht aus einem Metallrahmen mit Druckhebel und zwei Plexiglasplatten;
7.2.2 Filterpapier (60 mm x 60 mm) mit definierter Saugfähigkeit 12
7.2.3 Schere und Pinzette;
7.2.4 Feiner Filzstift mit wasserunlöslicher Farbe oder Kopierstift;
7.2.5 Silikonscheibe (Durchmesser: 16 mm; Dicke: 2 mm) 13 und Kontrollschablone (Klarsichtfolie) zur Überprüfung des Pressdruckes des Gerätes;
7.2.6 Auswerteschablone zur Bestimmung der Flüssigkeits- und Fleischflächenränder, bestehend aus 15 Kreisen definierter Durchmesser auf durchsichtiger Kunststoffolie (s. Muster nach Nummer 7.6).
7.3 Untersuchungsmaterial
Aus dem zu untersuchenden Fleischstück (bei Tierkörpern: M. semimembranosus (Schwein) bzw. M. adductor (Rind) sowie M. longissimus dorsi) werden an zwei Stellen mit Schere und Pinzette Muskulaturstückchen ohne Fett- und Bindegewebe in einer Menge von mindestens 2 g entnommen. Bei abgetrockneten Oberflächen sind die Proben aus der Tiefe des Gewebes zu entnehmen.
7.4 Durchführung
Die Untersuchungen sind unmittelbar im Anschluss an die Probenahme (Q1 = Meßwert nach einer Stunde) bzw. nach 24 Stunden (Meßwert Q24) vorzunehmen.
Eine objektive Bewertung der erzielten Pressflächen setzt einen möglichst einheitlichen Pressdruck voraus. Da die Kompressorien herstellermäßig nicht standardisiert sind und zudem der Abnutzung unterliegen, ist der Pressdruck der Geräte vor Gebrauch anhand einer Referenzpressfläche zu überprüfen.
7.4.1 Erstellung der Referenzpressfläche
Zur Erstellung der Referenzpressfläche wird die Silikonscheibe in möglichst mehreren als Vorlage dienenden, neuwertigen Kompressorien gepreßt und die gepreßte Fläche (arithmetisches Mittel der Einzelmeßwerte) mit einem Filzstift auf die Auswerteschablone übertragen.
7.4.2 Überprüfung des Braunschweiger Gerätes
Vor jeder Verwendung des Braunschweiger Gerätes ist der erforderliche Pressdruck zu überprüfen und ggf. zu regulieren. Dazu wird die Silikonscheibe auf die Mitte der unteren Plexiglasscheibe gelegt und nach Auflegen der oberen Scheibe gepreßt. Die Pressfläche muss mit der Referenzfläche der Kontrollschablone übereinstimmen. Abweichungen sind durch Drehen, Wenden oder Austauschen der Plexiglasscheiben auszugleichen. Ist eine Korrektur nicht möglich, ist das Gerät zu ersetzen.
7.4.3 Durchführung der Pressung
Auf die untere Plexiglasscheibe des Gerätes wird Filterpapier aufgelegt. Mit Schere und Pinzette wird ein etwa erbsengroßes Stück Muskulatur von ca. 0,3 g aus dem jeweiligen Probenmaterial herausgeschnitten und auf die Mitte des Filterpapiers gelegt. Nach Auflegen der oberen Plexiglasfläche wird der Druckhebelmechanismus betätigt. Der Pressdruck soll 5 Minuten einwirken. Nach Aufheben des Pressdruckes und Entfernen der unteren Plexiglasscheibe wird der Umriß der Fleischfläche - bei undeutlicher Markierung auch der Umriß der Gesamtfläche - mit einem Stift im Gegenlicht markiert. Die Filterpapierscheibe wird von der oberen Plexiglasscheibe abgezogen und nach Entfernung des Fleischfilms und Beschriftung zum Abtrocknen plan auf die Unterlage gelegt. Sie kann nach der Auswertung zur Dokumentation aufbewahrt werden.
7.5 Auswertung
7.5.1 Verfahren
Zur Auswertung sind Pressproben geeignet, die annähernd runde Umrissbilder erkennen lassen. Die Gesamtpressfläche F, bestimmt durch den äußeren Rand der Feuchtigkeitszone, und die zentrale Fläche der Fleischzone f werden den passenden numerierten Kreisen der Auswerteschablone durch Verschieben der Schablone über der abgetrockneten Filterpapierscheibe zugeordnet. Über- und unterragende Randverläufe werden durch Abschätzung ausgeglichen. Bei nicht klar zuzuordnenden Ringwerten können auch Zwischenstufen als Ergebnis gewertet werden. Der Quotient Q aus Fleischfläche f und Gesamtfläche F wird anhand der entsprechenden Schablonennummern aus der Auswertetabelle nach Nummer 7.6.1 abgelesen. Er wird berechnet nach der Formel
| f | |
| Q = | |
| F |
7.5.2 Erläuterungen und Hinweise
7.5.2.1 Richtwerte
Niedrige Quotientenwerte "Q", die auf einer großen auspressbaren Flüssigkeitsmenge beruhen zeigen eine geringe Wasserbindung des Fleisches an. Umgekehrt lassen hohe Quotientenwerte auf eine Reduzierung der auspressbaren Flüssigkeitsmenge und infolgedessen auf eine hohe Wasserbindung schließen.
Die sich aus den geschätzten sichtbaren Flächenanteilen ergebenden Quotienten können nach Nummer 7.6.2 ermittelt werden; Richtwerte für eine abweichende Wasserbindung sind unter Nummer 7.6.3 aufgeführt.
7.5.2.2 Beurteilung des Ausblutungsgrades
Eine starke Rotfärbung der Flüssigkeitsringzone ist als Hinweis auf eine schlechte Ausblutung zu werten.
7.6 Muster der Auswerteschablone nach Nummer 7.2.6, Umrechnungstabelle nach Nummer 7.5.1 sowie Tabellen zur Richtwertermittlung nach Nummer 7.5.2.1
7.6.1 Auswerteschablone zur Bestimmung der Flüssigkeits- und Fleischflächenränder
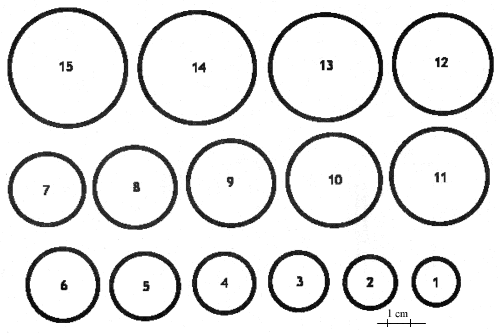
7.6.2 Tabelle zur Flächenberechnung nach der Auswerteschablone
| Schablonen [Nr.] |
Radius [mm] |
Durchmesser [mm] |
Fläche [cm2] |
| 1 | 10 | 20 | 3,14 |
| 2 | 11 | 22 | 3,80 |
| 3 | 12 | 24 | 4,52 |
| 4 | 13 | 26 | 5,30 |
| 5 | 14 | 28 | 6,16 |
| 6 | 15 | 30 | 7,06 |
| 7 | 16 | 32 | 8,03 |
| 8 | 17 | 34 | 9,07 |
| 9 | 18 | 36 | 10,17 |
| 10 | 19 | 38 | 11,33 |
| 11 | 20 | 40 | 12,56 |
| 12 | 21 | 42 | 13,85 |
| 13 | 22 | 44 | 15,21 |
| 14 | 23 | 46 | 16,62 |
| 15 | 24 | 48 | 18,10 |
 |
weiter . |  |
(Stand: 20.01.2025)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: ab 105.- € netto
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion