 Für einen individuellen Ausdruck passen Sie bitte die
Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2015, Naturschutz/Tierschutz - EU Bund
 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2015, Naturschutz/Tierschutz - EU Bund |
Durchführungsbeschluss (EU) 2015/1358 der Kommission vom 4. August 2015 über die Änderung der Anhänge XI, XII und XV der Richtlinie 2003/85/EG des Rates in Bezug auf die Liste der für den Umgang mit MKS-Lebendviren zugelassenen Labors und die für diese geltenden Mindestnormen für die biologische Sicherheit
(Bekanntgegeben unter Aktenzeichen C(2015) 5341)
(Text von Bedeutung für den EWR)
(ABl. Nr. L 209 vom 06.08.2015 S. 11;
VO (EU) 2016/429 - ABl. Nr. L 84 vom 31.03.2016 S. 1aufgehoben)
aufgehoben (stillschweigend) gem. VO (EU) 2016/429
Die Europäische Kommission -
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Richtlinie 2003/85/EG des Rates vom 29. September 2003 über Maßnahmen der Gemeinschaft zur Bekämpfung der Maul- und Klauenseuche, zur Aufhebung der Richtlinien 85/511/EWG sowie der Entscheidungen 89/531/EWG und 91/665/EWG und zur Änderung der Richtlinie 92/46/EWG 1, insbesondere auf Artikel 67 Absatz 2 und Artikel 87 Absatz 3,
in Erwägung nachstehender Gründe:
(1) Die Richtlinie 2003/85/EG enthält Mindestmaßnahmen für den Fall eines Ausbruchs der Maul- und Klauenseuche sowie bestimmte Präventivmaßnahmen zur Sensibilisierung und Verbesserung der Vorsorge der zuständigen Behörden und der Landwirte hinsichtlich dieser Seuche.
(2) Gemäß den in der Richtlinie 2003/85/EG festgelegten Präventivmaßnahmen gewährleisten die Mitgliedstaaten unter anderem, dass der Umgang mit MKS-Lebendviren zu Zwecken der Forschung, der Diagnose oder der Impfstoffherstellung ausschließlich in den zugelassenen Labors erfolgt, die in Anhang XI der genannten Richtlinie aufgeführt sind.
(3) In Anhang XI Teil A der Richtlinie 2003/85/EG sind die nationalen Labors gelistet, die für den Umgang mit MKS- Lebendviren zu Forschungs- und Diagnosezwecken zugelassen sind. In Teil B des genannten Anhangs sind die Labors gelistet, die zur Impfstoffherstellung für den Umgang mit MKS-Lebendviren zugelassen sind.
(4) Kroatien und Litauen haben die Kommission offiziell darüber unterrichtet, dass ihr jeweiliges nationales Referenzlabor nach ihrer Auffassung nicht länger die Anforderungen an die biologische Sicherheit gemäß Artikel 65 Buchstabe d der Richtlinie 2003/85/EG erfüllt. Daher sollten die Einträge zu diesen Ländern aus der Liste in Anhang XI Teil a der genannten Richtlinie gestrichen werden. Griechenland und Ungarn haben wegen organisatorischer Umstellungen um eine Änderung der Bezeichnung ihres jeweiligen in der Liste aufgeführten nationalen Labors ersucht. Die Tschechische Republik hat um die Berichtigung eines Schreibfehlers in der Bezeichnung ihres in der Liste aufgeführten nationalen Labors ersucht.
(5) Aus Gründen der Rechtssicherheit ist es wichtig, dass die in Anhang XI Teil A der Richtlinie 2003/85/EG festgelegte Liste der nationalen Labors immer dem neuesten Stand entspricht. Daher ist es notwendig, die Einträge zu Kroatien und Litauen aus dieser Liste zu streichen, die Bezeichnungen der nationalen Labors der Tschechischen Republik, Griechenlands und Ungarns zu ändern sowie außerdem in der genannten Liste festzuhalten, dass das Pirbright Institute für Bulgarien, Kroatien, Litauen und Portugal die Dienste eines nationalen Referenzlabors erbringt.
(6) Deutschland hat wegen organisatorischer Umstellungen um die Änderung der Bezeichnung des in Anhang XI Teil B der Richtlinie 2003/85/EG gelisteten Labors ersucht. Des Weiteren sollte Teil B des genannten Anhangs dahingehend geändert werden, dass der für das Vereinigte Königreich verwendete ISO-Ländercode berichtigt wird.
(7) Daher sollte Anhang XI Teile A und B der Richtlinie 2003/85/EG entsprechend geändert werden.
(8) In Anhang XII Nummer 1 der Richtlinie 2003/85/EG sind die Normen für die biologische Sicherheit für Labors festgelegt, die mit MKS-Lebendviren umgehen. Dort heißt es, dass solche Labors mindestens die "Mindestnormen für Labors, die in vitro und in vivo mit MKS-Viren arbeiten" (minimum standards for laboratories working with footandmouth virus in vitro and in vivo) erfüllen müssen, die von der Europäischen Kommission zur Bekämpfung der Maul- und Klauenseuche auf ihrer 38. Tagung in Rom am 29. April 2009 verabschiedet wurden (Normen für die biologische Sicherheit). Eine überarbeitete Fassung dieser Normen für die biologische Sicherheit hat die Europäische Kommission zur Bekämpfung der Maul- und Klauenseuche auf ihrer 40. Tagung in Rom am 22.-24. April 2013 verabschiedet 2.
(9) Die überarbeitete Fassung der Normen für die biologische Sicherheit umfasst einen Abschnitt I zu Labors, die in vitro und in vivo mit MKS-Viren arbeiten, und einen Abschnitt II zu Labors, die im Rahmen eines nationalen Krisenplans diagnostische Untersuchungen zur Maul- und Klauenseuche durchführen.
(10) Daher sollte die Bezugnahme auf die Normen für die biologische Sicherheit in Anhang XII Nummer 1 der Richtlinie 2003/85/EG dahingehend geändert werden, dass sie auf den betreffenden Abschnitt der neuesten überarbeiteten Fassung dieser Normen verweist.
(11) Von Juni 2009 bis Juni 2012 machte die Kommission 19 Auditbesuche in 15 Mitgliedstaaten, in denen sich 16 nationale Labors und drei Labors zur Impfstoffherstellung befinden, die für den Umgang mit MKS- Lebendviren zugelassen und in Anhang XI der Richtlinie 2003/85/EG gelistet sind. Ziel dieser Auditbesuche war es, die amtlichen Kontrollen zu beurteilen und die von den jeweiligen Labors angewandten Biosicherheitssysteme zu bewerten. Die Ergebnisse der Auditbesuche wurden in einem Workshop zur biologischen Sicherheit für Labors, die mit MKS-Lebendviren umgehen, vorgestellt; dieser fand am 27. und 28. Januar 2015 in Grange, Irland, statt. Unmittelbar im Anschluss daran wurde der Auditbericht 3 veröffentlicht.
(12) Anhang XII Nummern 2 und 3 der Richtlinie 2003/85/EG bestimmt, dass Labors und Einrichtungen, die mit MKS-Lebendviren umgehen, kontrolliert werden müssen; außerdem sind dort die Kontrollhäufigkeit und die Zusammensetzung des Kontrollteams festgelegt. Aufgrund der Empfehlungen, die sich aus den Auditbesuchen der Kommission ergeben haben, und unter Berücksichtigung der Pflicht zur Durchführung amtlicher Kontrollen gemäß Artikel 45 der Verordnung (EG) Nr. 882/2004 des Europäischen Parlaments und des Rates 4 ist es möglich, regelmäßige und risikobasierte Kontrollen der Labors, die mit MKS-Lebendviren umgehen, vorzusehen, ohne genaue Intervalle und Teamzusammensetzungen festzulegen.
(13) Anhang XII der Richtlinie 2003/85/EG sollte daher entsprechend geändert werden.
(14) In Anhang XV der Richtlinie 2003/85/EG sind die Funktionen und Aufgaben der nationalen Labors aufgeführt. Im Interesse der Klarheit muss deutlich ausgedrückt werden, dass die in Nummer 3 des genannten Anhangs beschriebenen Pflichten nur für diejenigen nationalen Labors gelten, die gemäß Artikel 68 Absatz 1 Buchstabe c der genannten Richtlinie als nationales Referenzlabor benannt wurden.
(15) Ein weiteres Ergebnis der Auditbesuche in den Mitgliedstaaten und der Diskussion in dem Workshop vom 27. und 28. Januar 2015 war, dass die Mitgliedstaaten die anderen in Anhang XV Nummer 13 der Richtlinie 2003/85/EG genannten Labors in ihren Krisenplänen vorab aufführen und dafür Sorge tragen sollten, dass die Maßnahmen zur Verhütung einer Freisetzung des MKS-Virus auf den Empfehlungen basieren, die in den Normen für die biologische Sicherheit, Abschnitt II (Labors, die im Rahmen eines nationalen Krisenplans diagnostische Untersuchungen zur Maul- und Klauenseuche durchführen), gegeben werden.
(16) Anhang XV der Richtlinie 2003/85/EG sollte daher entsprechend geändert werden.
(17) Somit sollte die Richtlinie 2003/85/EG entsprechend geändert werden.
(18) Die in diesem Beschluss vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ständigen Ausschusses für Pflanzen, Tiere, Lebensmittel und Futtermittel
- hat folgenden Beschluss erlassen:
Die Anhänge XI, XII und XV der Richtlinie 2003/85/EG werden gemäß dem Anhang des vorliegenden Beschlusses geändert.
Dieser Beschluss ist an die Mitgliedstaaten gerichtet.
Brüssel, den 4. August 2015
2) http://www.fao.org/fileadmin/user_upload/eufmd/Lab_guidelines/FMD_Minimumstandards_2013_Final_version.pdf.
3) Bericht DG(SANCO) 2012-6916, abrufbar unter http://ec.europa.eu/food/fvo/overview_reports/details.cfm?rep_id=71.
4) Verordnung (EG) Nr. 882/2004 des Europäischen Parlaments und des Rates vom 29. April 2004 über amtliche Kontrollen zur Überprüfung der Einhaltung des Lebensmittel- und Futtermittelrechts sowie der Bestimmungen über Tiergesundheit und Tierschutz (ABl. Nr. L 165 vom 30.04.2004 S. 1).
| Anhang |
Die Anhänge XI, XII und XV der Richtlinie 2003/85/EG werden wie folgt geändert:
1. In Anhang XI erhalten die Teile A und B folgende Fassung:
"Teil A
Nationale Labors, die für den Umgang mit MKS-Lebendviren zugelassen sind
| Mitgliedstaat, in dem das Labor ansässig ist | Labor | Mitgliedstaaten, die die Dienste des Labors in Anspruch nehmen | |
| ISO-Code | Bezeichnung | ||
| AT | Österreich | Österreichische Agentur für Gesundheit und Ernährungssicherheit Veterinärmedizinische Untersuchungen Mödling | Österreich |
| BE | Belgien | Veterinary and Agrochemical Research Centre CODA-CERVA- VAR, Uccle | Belgien Luxemburg |
| CZ | Tschechische Republik | Státní veterinární ústav Praha, Praha | Tschechische Republik |
| DE | Deutschland | Friedrich-Loeffler-Institut
Bundesforschungsinstitut für Tiergesundheit, Greifswald - Insel Riems |
Deutschland Slowakei |
| DK | Dänemark | Danmarks Tekniske Universitet, Veterinierinstituttet, Afdeling for Virologi, Lindholm
Danish Technical University, Veterinary Institute, Department of Virology, Lindholm |
Dänemark Finnland Schweden |
| EL | Griechenland |  |
Griechenland |
| ES | Spanien |
|
Spanien |
| FR | Frankreich | Agence nationale de sécurité sanitaire de l'alimentation, de l'envi- ronnement et du travail (ANSES), Laboratoire de santé animale de Maisons-Alfort | Frankreich |
| HU | Ungarn | Nemzeti Élelmiszerlánc-biztonsági Hivatal, Ällategészségügyi Diagnosztikai Igazgatóság (NÉBIH-ÄDI), Budapest | Ungarn |
| IT | Italien | Istituto zooprofilattico sperimentale della Lombardia e dell'Emi- lia-Romagna, Brescia | Italien Zypern |
| NL | Niederlande | Centraal Veterinair Instituut, Lelystad (CVI- Lelystad) | Niederlande |
| PL | Polen | 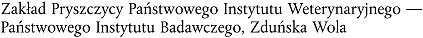 |
Polen |
| RO | Rumänien | 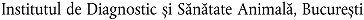 |
Rumänien |
| UK | Vereinigtes Königreich | The Pirbright Institute | Vereinigtes Königreich Bulgarien Kroatien Estland Finnland Irland Lettland Litauen Malta Portugal Slowenien Schweden |
Teil B
Labors, die zur Impfstoffherstellung für den Umgang mit MKS-Lebendviren zugelassen sind
| Mitgliedstaat, in dem das Labor ansässig ist | Labor | |
| ISO-Code | Bezeichnung | |
| DE | Deutschland | Intervet International GmbH/MSD Animal Health, Köln |
| NL | Niederlande | Merial S.A.S., Lelystad Laboratory, Lelystad |
| UK | Vereinigtes Königreich | Merial, S.A.S., Pirbright Laboratory, Pirbright" |
2. Anhang XII erhält folgende Fassung:
" Anhang XII
Biologische Sicherheit für Labors und Einrichtungen, die mit MKS-Lebendviren umgehen
1. Labors und Einrichtungen, die mit MKS-Lebendviren umgehen, arbeiten mindestens nach Abschnitt I der Mindestnormen für das Management biologischer Risiken durch Labors, die in vitro und in vivo mit MKS-Viren arbeiten ("Minimum biorisk management standards for laboratories working with foot-and-mouth disease virus in vitro and in vivo"), gemäß Anlage 7 zu dem Bericht, der auf der 40. Tagung der Europäischen Kommission zur Bekämpfung der MKS am 22.-24. April 2013 in Rom verabschiedet wurde (Normen für die biologische Sicherheit)1.
2. Labors und Einrichtungen, die mit MKS-Lebendviren umgehen, unterliegen regelmäßigen und risikobasierten Kontrollen, einschließlich der von der Europäischen Kommission und in ihrem Namen durchgeführten Kontrollen.
3. Das Kontrollteam kann auf die in der Kommission oder in einem Mitgliedstaat vorhandene Expertise hinsichtlich der Maul- und Klauenseuche sowie der Biosicherheit in Labors, die mikrobiologischen Gefahren ausgesetzt sind, zurückgreifen.
4. Die von der Europäischen Kommission eingesetzten Kontrollteams legen ihr und den Mitgliedstaaten gemäß der Entscheidung 98/139/EG einen Bericht vor.
____
1) http://www.fao.org/fileadmin/user_upload/eufmd/Lab_guidelines/FMD_Minimumstandards_2013_Final_version.pdf"
3. Anhang XV wird wie folgt geändert:
a) Nummer 3 erhält folgende Fassung:
"3. Die gemäß Artikel 68 Absatz 1 Buchstabe c als nationales Referenzlabor benannten nationalen Labors halten inaktivierte Referenzstämme aller MKSV-Serotypen, Immunseren gegen die betreffenden Viren sowie alle weiteren Reagenzien vorrätig, die für eine Schnelldiagnose erforderlich sind. Zur Bestätigung eines Negativbefunds sollten ständig geeignete Zellkulturen bereitstehen."
b) Nummer 13 erhält folgende Fassung:
"13. Die nationalen Labors arbeiten zur Durchführung von Tests, beispielsweise serologischer Untersuchungen, die keinen Umgang mit MKS-Lebendviren erfordern, mit anderen von den zuständigen Behörden bezeichneten Labors zusammen, die in den in Artikel 72 genannten Krisenplänen für die Maul- und Klauenseuche aufgeführt sind. Diese Labors führen keine Virusisolierung (durch Infektion von Zellen oder Tieren) mittels Proben durch, die in Fällen des Verdachts auf eine Vesikulärerkrankung entnommen wurden. Solche Labors müssen nach Verfahren arbeiten, die gewährleisten, dass die Ausbreitung eventuell vorhandener MKS-Viren wirksam verhindert wird; zu berücksichtigen sind hierbei die Empfehlungen in Abschnitt II der Mindestnormen für das Management biologischer Risiken durch Labors, die in vitro und in vivo mit MKS- Viren arbeiten ("Minimum biorisk management standards for laboratories working with foot-and-mouth disease virus in vitro and in vivo"), gemäß Anlage 7 zu dem Bericht, der auf der 40. Tagung der Europäischen Kommission zur Bekämpfung der MKS am 22.-24. April 2013 in Rom verabschiedet wurde (Normen für die biologische Sicherheit)1.
Proben, die mit unschlüssigem Ergebnis analysiert wurden, sind zur Durchführung von Bestätigungstests an das nationale Referenzlabor weiterzuleiten.
_______
1) http://www.fao.org/fileadmin/user_upload/eufmd/Lab_guidelines/FMD_Minimumstandards_2013_Final_version.pdf."
 |
ENDE |
(Stand: 20.04.2021)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: 90.- € netto (Grundlizenz)
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion
...
X
⍂
↑
↓