

 |
zurück |  |
| Bestimmung der Ökotoxizität
C.3. Algeninhibitionstest |
Anhang V zur RL 67/548/EWG |
C.3. 1. Methode
C.3. 1.1. Einleitung
Mit diesem Test soll die Wirkung einer Substanz auf das Wachstum einer einzelligen Grünalgenart bestimmt werden. Mit verhältnismäßig kurzen Tests (72 Stunden) läßt sich die Wirkung über mehrere Generationen ermitteln. Dieses Verfahren kann für die Anwendung bei zahlreichen einzelligen Algenarten variiert werden. In diesem Fall ist dem Prüfbericht eine Beschreibung des verwendeten Verfahrens beizufügen.
Dieses Verfahren läßt sich am einfachsten auf wasserlösliche Substanzen anwenden, von denen angenommen werden kann, daß sie unter den Prüfbedingungen im Wasser bleiben.
Das Verfahren kann für Substanzen verwendet werden, die keinen direkten Einfluß auf die Messung des Algenwachstums haben. Soweit möglich, sollten Angaben über die Wasserlöslichkeit, den Dampfdruck, die chemische Stabilität, die Dissoziationskonstanten und die biologische Abbaubarkeit der Prüfsubstanz vor dem Beginn der Prüfung vorhanden sein.
Weitere Angaben (z.B. Strukturformel, Reinheitsgrad, Art und Prozentanteil signifikanter Verunreinigungen, Vorhandensein und Menge von Zusätzen sowie der n-Oktanol/Wasser-Verteilungskoeffizient) sind sowohl bei der Planung der Prüfung als auch bei der Interpretation der Prüfergebnisse zu berücksichtigen.
C.3. 1.2. Definitionen und Einheiten
Zelldichte: Anzahl der Zellen pro Milliliter;
Wachstum: Zunahme der Zelldichte im Prüfzeitraum;
Wachstumsrate: Zunahme der Zelldichte pro Zeiteinheit;
EC50: bei diesem Verfahren diejenige Konzentration der Prüfsubstanz, die im Vergleich zur Kontrolle zu einer 50%igen Abnahme entweder des Wachstums (EbC50) oder der Wachtumsrate (ErC50) führt;
NOEC (no observed effect concentration): bei diesem Verfahren die höchste geprüfte Konzentration, bei der im Vergleich zur Kontrolle keine signifikante Wachstumshemmung beobachtet wird.
Alle Konzentrationen der Prüfsubstanz sind in Gewicht/Volumen (mg/l) anzugeben. Sie können auch als Gewichtsanteile (mg/kg) angegeben werden.
C.3. 1.3. Referenzsubstanzen
Eine Referenzsubstanz kann getestet werden, um nachzuweisen, daß sich die Empfindlichkeit der geprüften Art unter den Bedingungen der Prüfeinrichtung nicht wesentlich geändert hat.
Wird eine Referenzsubstanz getestet, so sind die Ergebnisse im Prüfbericht anzugeben. Kaliumdichromat kann als Referenzsubstanz verwendet werden, doch kann seine Farbe die für die Zellen zur Verfügung stehende Lichtqualität und -intensität und ggf. auch die spektrophotometrischen Bestimmungen beeinträchtigen. Kaliumdichromat ist in einem internationalen Ring-Test (vgl. Literaturstelle (3) und Anlage 2) verwendet worden.
C.3. 1.4. Prinzip der Methode
Es kann ein Limit-Test mit 100 mg/l durchgeführt werden, um nachzuweisen, daß die EC50 über dieser Konzentration liegt.
Exponentiell wachsende Kulturen ausgewählter Grünalgen werden verschiedenen Konzentrationen der Prüfsubstanz über mehrere Generationen und unter genau definierten Bedingungen ausgesetzt.
Die Prüflösungen werden über einen Zeitraum von 72 Stunden inkubiert. In dieser Zeit wird die Zelldichte in jeder Lösung mindestens alle 24 Stunden gemessen. Die Hemmung des Wachstums wird im Vergleich zu einer Kontrollkultur bestimmt.
C.3. 1.5. Qualitätskriterien
Die Qualitätskriterien gelten sowohl für den Limit-Test als auch für das vollständige Prüfverfahren.
Die Zelldichte in den Kontrollkulturen sollte innerhalb von drei Tagen um einen Faktor von mindestens 16 zugenommen haben.
Die Konzentration der Prüfsubstanz soll über den gesamten Prüfzeitraum bei bis zu 80 % der Anfangskonzentration gehalten werden.
Bei Substanzen, die im Prüfmedium leicht löslich sind und stabile Lösungen ergeben, d. h. Lösungen, die sich nicht in signifikantem Masse verflüchtigen oder nicht in einem solchen Masse abgebaut, hydrolisiert oder adsorbiert werden, kann die Anfangskonzentration als der nominalen Konzentration gleichwertig angesehen werden. Es ist nachzuweisen, daß die Konzentrationen über den gesamten Prüfzeitraum aufrechterhalten und die Qualitätskriterien erfüllt worden sind.
Bei Substanzen, die
soll die Anfangskonzentration diejenige Konzentration sein, die bei Prüfbeginn gemessen worden ist. Die Konzentration soll nach einer Zeit der Äquilibrierung bestimmt werden.
In all diesen Fällen müssen im Verlauf der Prüfung weitere Messungen durchgeführt werden, um zu bestätigen, daß die Expositionskonzentrationen tatsächlich erreicht und die Qualitätskriterien erfüllt worden sind.
Es wird davon ausgegangen, daß beachtliche Mengen der Prüfsubstanz während des Prüfzeitraums in die Algenbiomasse aufgenommen werden. Um daher nachweisen zu können, daß die oben genannten Qualitätskriterien erfüllt worden sind, sollten sowohl die in die Algenbiomasse aufgenommene Substanz als auch die Substanz in der Lösung (oder, wenn dies aus technischen Gründen nicht möglich ist, in der Wassersäule) gemessen werden. Da jedoch die Bestimmung der Substanzkonzentration in der Algenbiomasse größere technische Schwierigkeiten verursachen kann, kann man die Erfüllung der Qualitätskriterien durch Mitführen eines Prüfgefäßes mit der höchsten Substanzkonzentration - jedoch ohne Algen - sowie durch Messung der Konzentrationen in der Lösung (oder, wenn technisch nicht möglich, in der Wassersäule) bei Prüfbeginn und bei Prüfende nachweisen.
C.3. 1.6. Beschreibung der Methode
C.3. 1.6.1. Reagenzien
C.3. 1.6.1.1. Lösungen der Prüfsubstanzen
Die Stammansätze in den erforderlichen Konzentrationen werden durch Lösung der Prüfsubstanz in deionisiertem Wasser oder Wasser entsprechend 1.6.1.2. hergestellt.
Die gewählten Prüfkonzentrationen werden durch Hinzufügen geeigneter aliquoter Teile zu den Algenvorkulturen hergestellt (siehe Anlage 1). Die Substanzen sollten im allgemeinen nur bis zur Löslichkeitsgrenze geprüft werden. Bei einigen Substanzen (z.B. bei solchen mit geringer Wasserlöslichkeit oder hohem Pow oder solchen, die im Wasser eher eine stabile Dispersion als eine echte Lösung bilden), kann es angezeigt sein, eine Prüfkonzentration zu verwenden, die oberhalb der Löslichkeitsgrenze der Substanz liegt, um sicherzustellen, daß die höchste lösliche/stabile Konzentration erreicht worden ist. Wichtig ist jedoch, daß diese Konzentration das Prüfsystem nicht auf sonstige Weise stört (z.B. durch Bildung eines Substanzfilms auf der Wasseroberfläche, durch den die Anreicherung des Wassers mit Sauerstoff verhindert wird).
Durch Ultraschalldispersion, Verwendung organischer Lösungsmittel und emulgierender oder dispergierender Mittel können Stammansätze von Prüfsubstanzen mit geringer Wasserlöslichkeit hergestellt oder deren Dispersion im Prüfmedium gefördert werden. Werden derartige Hilfsstoffe verwendet, müssen alle Prüfkonzentrationen die gleiche Menge des Hilfsstoffes enthalten und müssen zusätzliche Kontrollen derselben Konzentration an Hilfsstoffen ausgesetzt werden, wie sie in der Prüfreihe verwendet wurde. Die Konzentration derartiger Hilfsstoffe sollte niedrig gehalten werden, in keinem Fall jedoch 100 mg/l im Prüfmedium überschreiten.
Die Prüfung ist ohne eine Einstellung des pH-Wertes durchzuführen. Gibt es Anzeichen für eine deutliche Änderung des pH-Wertes, wird empfohlen, die Prüfung mit einer pH-Wert-Einstellung zu wiederholen und die Ergebnisse entsprechend zu protokollieren. In diesem Fall ist der pH-Wert des Stammansatzes auf den pH-Wert des Verdünnungswassers einzustellen, falls nicht bestimmte Gründe dagegen sprechen. Hierzu sind möglichst HCl und NaOH zu verwenden. Die pH-Wert-Einstellung muß so erfolgen, daß sich die Konzentration der Prüfsubstanz im Stammansatz nicht wesentlich ändert. Sollte sich durch die Einstellung eine chemische Reaktion oder eine physikalische Ausfällung des Prüfsubstanz ergeben, so muß diese Beobachtung im Prüfbericht protokolliert werden.
C.3. 1.6.1.2. Prüfmedium
Das Wasser muß einwandfreies destilliertes oder deionisiertes Wasser mit einer Leitfähigkeit von weniger als 5 µScm-1 sein. Die für die Destillation von Wasser verwendete Apparatur darf keine Kupferteile enthalten.
Es wird das folgende Medium empfohlen.
Vier Stammansätze werden nach der folgenden Tabelle hergestellt. Die Stammansätze werden durch Membranfiltrierung oder durch autoklavieren sterilisiert und bei 4 °C im Dunkeln aufbewahrt. Stammansatz Nr. 4 sollte nur durch Membranfiltrierung sterilisiert werden. Diese Stammansätze werden verdünnt, um die endgültigen Nährkonzentrationen in den Prüflösungen zu erhalten.
| Nährstoff | Konzentration im Stammansatz | Endgültige Konzentration in Prüflösung |
| Stammansatz 1: Makronährstoffe | ||
| NH4Cl | 1,5 g/l | 15 mg/l |
| MgCl2 ξ 6H2O | 1,2 g/l | 12 mg/l |
| CaCl2 ξ 2H2O | 1,8 g/l | 18 mg/l |
| MgSO4 ξ 7H2O | 1,5 g/l | 15 mg/l |
| KH2PO4 | 0,16 g/l | 1,6 mg/l |
| Stammansatz 2: Fe-EDTA | ||
| FeCl3 ξ 6H2O | 80 mg/l | 0,08 mg/l |
| Na2EDTa ξ 2H2O | 100 mg/l | 0,1 mg/l |
| Stammansatz 3: Spurenelemente | ||
| H3BO3 | 185 mg/l | 0,185 mg/l |
| MnCl2 ξ 4H2O | 415 mg/l | 0,415 mg/l |
| ZnCl2 | 3 mg/l | 3ξ 10-3mg/l |
| CoCl2 ξ 6 H2O | 1,5 mg/l | 1,5ξ 10-3 mg/l |
| CuCl2 ξ 2H2O | 0,01 mg/l | 10-5mg/l |
| Na2MoO4 ξ 2H2O | 7 mg/l | 7ξ 10-3 mg/l |
| Stammansatz 4: NaHCO3 | ||
| NaHCO3 | 50 g/l | 50 mg/l |
Der pH-Wert des Mediums nach der Äquilibrierung mit Luft liegt bei etwa 8.
C.3. 1.6.2. Geräte
Bei Prüflösungen mit durchschnittlicher Konzentration wird eine Lichtintensität zwischen 60 und 120 µE⋅ m-2⋅s-1 (35 bis 70 ξ 1018 Photonen⋅ m-2⋅s-1) empfohlen; die Messung wird unter Verwendung eines geeigneten Detektors im Bereich zwischen 400 und 700 nm vorgenommen. Für in Lux-Einheiten geeichte Lichtmeßinstrumente ist ein äquivalenter Bereich von 6000 bis 10.000 lx akzeptabel.
Die Lichtintensität kann durch Verwendung von vier bis sieben Fluoreszenzlampen (30 W) des Typs Universalweiß (Farbtemperatur etwa 4300 K) erreicht werden, die 0,35 m von der Algenkultur entfernt sind.
C.3. 1.6.3. Prüforganismen
Es wird vorgeschlagen, eine schnellwachsende Grünalgenart zu verwenden, die sich für Kultur- und Prüfzwecke eignet. Dabei sind folgende Arten zu bevorzugen:
Anmerkung:
| ATCC | = American type Culture Collection (U.S.A.) |
| CCAP | = Culture Centre of Algae and Protozoa (U.K.) |
| SAG | = Sammlung Algenkulturen (Göttingen, Deutschland) |
Wenn andere Arten verwendet werden, ist der Stamm anzugeben.
C.3. 1.6.4. Durchführung der Prüfung
Der Konzentrationsbereich, in dem Wirkungen zu erwarten sind, wird anhand von Ergebnissen aus Vorversuchen ermittelt.
Die beiden Wachstumsparameter (Biomasse und Wachstumsrate) können zu stark voneinander abweichenden Werten für die Wachstumshemmung führen; beide sollten im Vorversuch verwendet werden, um sicherzustellen, daß die geometrische Reihe der Konzentrationen die Ermittlung sowohl der EbC50 als auch der ErC50 möglich macht.
Anfängliche Zelldichte
Es wird empfohlen, daß die anfängliche Zelldichte bei Selenastrum capricornutum und Scenedesmus subspicatus in den Testkulturen bei etwa 104 Zellen/ml liegt. Wenn andere Arten verwendet werden, sollte die Biomasse einen vergleichbaren Wert aufweisen.
Konzentrationen der Prüfsubstanz
Für die Prüfung werden mindestens fünf Konzentrationen in geometrischer Reihe bei einem Konzentrationsverhältnis, das nicht über 2,2 liegen darf, hergestellt. Die niedrigste geprüfte Konzentration sollte keine feststellbare Wirkung auf das Algenwachstum haben. Die höchste geprüfte Konzentration sollte im Vergleich zu den Kontrollen zu einer mindestens 50 %igen Wachstumshemmung oder - besser noch - zu einem vollständigen Wachstumsstillstand führen.
Wiederholungen und Kontrollen
Das Prüfprotokoll sollte für jede Prüfkonzentration drei Wiederholungen vorsehen. Es werden drei Kontrollen ohne Prüfsubstanz mitgeführt, ggf. auch drei Kontrollen mit der Hilfssubstanz. Wenn es gerechtfertigt erscheint, kann das Prüfprotokoll dahin gehend geändert werden, daß eine höhere Anzahl an Konzentrationen und eine geringere Anzahl an Wiederholungen pro Konzentration durchgeführt wird.
Versuchsausführung
Prüfkulturen, die die gewünschten Konzentrationen der Prüfsubstanz und die gewünschte Menge des Algeninokulums enthalten, werden durch Hinzufügen aliquoter Teile der Stammlösungen der Prüfsubstanz zu geeigneten Mengen der Algenvorkulturen hergestellt (siehe Anlage 1).
Die Kulturflaschen werden geschüttelt und in den Inkubator gestellt. Die Algenzellen werden durch Schütteln, Rühren oder Belüften in Suspension gehalten, um den Gasaustausch zu verbessern und die Schwankung des pH-Wertes in den Prüflösungen zu reduzieren. Die Kulturen sind bei einer Temperatur zwischen 21 und 25 °C (innerhalb einer Toleranz von ± 2 °C) zu halten.
Die Zelldichte in jeder Flasche wird mindestens 24, 48 und 72 Stunden nach Prüfbeginn bestimmt. Das filtrierte Algenmedium, das die Prüfsubstanz in der entsprechenden Konzentration enthält, wird zur Bestimmung des Hintergrunds verwendet, wenn zur Zelldichtemessung andere Methoden als direkte Zählverfahren Anwendung finden.
Der pH-Wert wird zu Beginn der Prüfung und nach 72 Stunden gemessen.
Der pH-Wert der Kontrollen sollte während der Prüfung normalerweise nicht um mehr als 1,5 Einheiten schwanken.
Prüfung flüchtiger Substanzen
Es gibt bislang noch kein allgemein anerkanntes Verfahren zur Prüfung flüchtiger Substanzen. Wenn sich eine Substanz bekanntermaßen leicht verflüchtigt, können geschlossene Prüfflaschen mit mehr Luftraum verwendet werden. Bei der Berechnung des Luftraums der geschlossenen Flaschen sollte an die Möglichkeit eines CO2-Mangels gedacht werden. Es gibt bereits Vorschläge für Änderungen dieses Verfahrens (siehe (4)).
Es sollte versucht werden, die in der Lösung verbleibende Substanzmenge zu bestimmen. Äußerste Vorsicht ist bei der Interpretation der Ergebnisse von Prüfungen mit flüchtigen Substanzen bei Verwendung geschlossener Systeme geboten.
Limit-Test
Unter Verwendung der bei diesem Prüfverfahren beschriebenen Methoden kann ein Limit-Test mit 100 mg/l durchgeführt werden, um nachzuweisen, daß die EC50 über dieser Konzentration liegt.
Wenn die Substanz so beschaffen ist, daß eine Konzentration von 100 mg/l im Prüfwasser nicht erreicht werden kann, ist der Limit-Test bei einer Konzentration durchzuführen, die der Löslichkeit der Substanz (oder der höchsten Konzentration, die eine stabile Dispersion bildet) im verwendeten Medium entspricht (vgl. auch Punkt 1.6.1.1.).
Der Limit-Test ist mindestens dreifach und mit der gleichen Anzahl von Kontrollen durchzuführen. Die beiden Wachstumsparameter (Biomasse und Wachstumsrate) sind für den Limit-Test zu verwenden.
Wenn bei einem Limit-Test im Vergleich zur Kontrolle eine mittlere Abnahme der Biomasse oder der Wachstumsrate um 25 % oder darüber festgestellt wird, ist das vollständige Prüfverfahren anzuwenden.
C.3. 2. Daten und Auswertung
Die gemessene Zelldichte in den Prüfkulturen und den Kontrollen wird zusammen mit den Konzentrationen der Prüfsubstanz und den Meßzeiten tabellarisch zusammengefaßt. Zur Erzeugung der Wachstumskurven wird der Mittelwert der Zelldichte für jede Prüfkonzentration und für die Kontrollen gegen die Zeit (0-72 h) aufgetragen. Zur Bestimmung des Konzentrations-Wirkungs-Verhältnisses sollten die beiden folgenden Verfahren verwendet werden. Einige Substanzen können das Wachstum bei niedrigen Konzentrationen fördern. Es sind nur solche Datenpunkte zu berücksichtigen, die eine Hemmwirkung zwischen 0 und 100 % angeben.
C.3. 2.1. Vergleich der Flächen unter den Wachstumskurven
Die Fläche zwischen den Wachstumskurven und der horizontalen Linie
N = N0 kann nach folgender Formel berechnet werden:
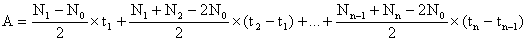
wobei
| A | = Fläche, |
| N0 | = Anzahl der Zellen/ml zum Zeitpunkt t0 (Prüfbeginn), |
| N1 | = gemessene Anzahl der Zellen/ml zum Zeitpunkt t1, |
| Nn | = gemessene Anzahl der Zellen/ml zum Zeitpunkt tn, |
| t1 | = Zeitpunkt der ersten Messung nach Prüfbeginn, |
| tn | = Zeitpunkt der n. Messung nach Prüfbeginn, |
| n | = Anzahl der nach Prüfbeginn durchgeführten Messungen. |
Die prozentuale Hemmung des Zellwachstums für jede Konzentration der Prüfsubstanz (IA) wird nach folgender Formel berechnet:
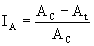 ξ 100
ξ 100
wobei
Ac = Fläche zwischen der Wachstumskurve der Kontrolle und der horizontalen Linie N = N0.
At = Fläche zwischen der Wachstumskurve bei der Konzentration t und der horizontalen Linie N = N0.
Die IA-Werte werden auf semilogarithmischem Papier oder auf semilogarithmischem Wahrscheinlichkeitspapier gegen die entsprechenden Konzentrationen aufgetragen. Bei Verwendung von Wahrscheinlichkeitspapier wird die Gerade - entweder mit blossem Auge oder über Regressionsrechnung - an die Meßwerte angepaßt.
Die EC50 wird aus der Regressionsgeraden durch Ablesen der Konzentration, die einer 50%igen Hemmung entspricht (Ia = 50 %), ermittelt. Um diesen Wert im Zusammenhang mit diesem Berechnungsverfahren eindeutig zu kennzeichnen, wird vorgeschlagen, das Symbol EbC50 zu verwenden. Es ist wichtig, daß die EbC50 zusammen mit dem entsprechenden Expositionszeitraum angegeben wird, z.B. EbC50 (0-72 h).
C.3. 2.2. Vergleich zwischen den Wachstumsraten
Die durchschnittliche spezifische Wachstumsrate (µ) für Kulturen mit exponentiellem Wachstum kann ermittelt werden als
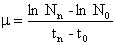
wobei t0 der Zeitpunkt zu Prüfbeginn ist.
Die durchschnittliche spezifische Wachstumsrate kann aber auch aus der Neigung der Regressionsgeraden in einer ln N-Zeit-Darstellung abgeleitet werden. Die prozentuale Hemmung der spezifischen Wachstumsrate bei den einzelnen Konzentrationen der Prüfsubstanz (Iµt) wird nach folgender Formel berechnet:
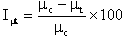
wobei
µc = mittlere spezifische Wachstumsrate der Kontrolle
µt = mittlere spezifische Wachstumsrate bei der Prüfkonzentration t
Die prozentuale Verminderung der durchschnittlichen spezifischen Wachstumsrate bei den einzelnen Konzentrationen gegenüber dem Kontrollwert wird gegen den Logarithmus der Konzentration aufgetragen. Die EC50 läßt sich aus der daraus entstehenden Kurve ablesen. Um die mit diesem Verfahren abgeleitete EC50 eindeutig zu kennzeichnen, wird vorgeschlagen, das Symbol ErC50 zu verwenden. Die Meßzeitpunkte sind anzugeben, d. h. wenn sich der Wert auf Zeitpunkte zwischen 0 und 72 Stunden bezieht, wird das Symbol ErC50 (0-72 h) verwendet.
Anmerkung: "Spezifische Wachstumsrate" ist ein logarithmischer Ausdruck, und kleine Veränderungen in der Wachstumsrate können zu großen Veränderungen in der Biomasse führen. Die Werte für EbC und ErC sind daher numerisch nicht miteinander vergleichbar.
C.3. 2.3. Berechnung der NOEC
Die "no observed effect concentration" (NOEC) wird mit Hilfe eines geeigneten statistischen Verfahrens für den multiplen Vergleich (z.B. Varianzanalyse, Dunnett-Test) bestimmt, wobei die einzelnen Werte der Wiederholungen für die Flächen unter den Wachstumskurven a (siehe Punkt 2.1) oder für die spezifischen Wachstumsraten i (siehe Punkt 2.2) verwendet werden.
C.3. 3. Abschlußbericht
Im Prüfbericht ist, wenn möglich, folgendes anzugeben:
C.3. 4. Literatur
(1) OECD, Paris, 1981, Test Guideline 201, Decision of the Council C(81) 30 Final.
(2) Umweltbundesamt, Berlin, 1984, Verfahrensvorschlag "Hemmung der Zellvermehrung bei der Grünalge Scenedesmus subspicatus", in: Rudolph/Boje: Ökotoxikologie, ecomed, Landsberg, 1986.
(3) ISO 8692 - Water quality - Fresh water algal growth inhibition test with Scenedesmus subspicatus and Selenastrum capricornutum.
(4) S. Galassi and M. Vighi - Chemosphere, 1981, Vol. 10, 1123-1126.
Anlage 1
zur RL 67/548/EWG Anhang V C.3
Beispiel für ein Verfahren zur Herstellung von Algenkulturen
Allgemeine Beobachtungen
Zweck der Herstellung von Kulturen anhand des folgenden Verfahrens ist der Erhalt von Algenkulturen für Toxizitätsprüfungen.
Es sind geeignete Verfahren anzuwenden, um sicherzustellen, daß die Algenkulturen nicht mit Bakterien infiziert sind (ISO 4833). Axenische Kulturen mögen wünschenswert sein, notwendig sind Kulturen mit nur einer Algenart.
Alle Schritte sind unter sterilen Bedingungen durchzuführen, um eine Kontamination mit Bakterien und anderen Algen zu vermeiden. Kontaminierte Kulturen sind zurückzuweisen.
Verfahren zum Erhalt von Algenkulturen Zubereitung der Nährlösungen (Medien):
Das Medium kann durch Verdünnung von konzentrierten Stammnährlösungen zubereitet werden. Bei einem festen Medium wird 0,8 % Agar zugefügt. Das verwendete Medium muß steril sein. Die Autoklav-Sterilisierung kann zu einem Verlust an NH3 führen.
Stammkultur:
Als Stammkulturen werden kleine Algenkulturen verwendet, die regelmäßig in frisches Medium eingebracht und dort als Ausgangsprüfmaterial verwendet werden. Wenn die Kulturen nicht regelmäßig verwendet werden, werden sie auf geneigte Agarröhrchen aufgebracht. Sie werden mindestens alle zwei Monate einmal in ein frisches Medium übertragen.
Die Stammkulturen werden in konischen Flaschen kultiviert, die das entsprechende Medium (Volumen etwa 100 ml) enthalten. Werden die Algen bei 20 °C und ständiger Beleuchtung inkubiert, ist ein wöchentlicher Transfer erforderlich.
Während des Transfers wird eine bestimmte Menge der "alten" Kultur mit sterilen Pipetten in eine Flasche mit frischem Medium gebracht, so daß bei schnell wachsenden Arten die Anfangskonzentration etwa 100 mal niedriger ist als die der alten Kultur.
Die Wachstumsrate einer Art kann mit Hilfe der Wachstumskurve bestimmt werden. Wenn diese bekannt ist, läßt sich diejenige Dichte ermitteln, bei der die Kultur in das neue Medium übertragen werden sollte. Dies muß vor der Absterbephase der Kultur geschehen.
Vorkultur
Die Vorkultur soll eine entsprechende Menge Algen ergeben, die als Inokulum für die Prüfkulturen verwendet werden können. Die Vorkultur wird unter den Prüfbedingungen inkubiert und normalerweise bei weiterhin exponentiellem Wachstum nach einer Inkubationszeit von etwa drei Tagen verwendet. Wenn die Algenkulturen deformierte oder anomale Zellen enthalten, sind sie zu verwerfen.
Anlage 2
zur RL 67/548/EWG Anhang V C.3.
Der ISO-Standard 8692 (Water quality - Fresh water algal growth inhibition test with Scenedesmus subspicatus und Selenastrum capricornutum) gibt folgende Ergebnisse aus einem von 16 Labors durchgeführten Test mit Kaliumdichromat an:
| Mittelwert (mg/l) |
Bereich (mg/l) |
|
| ErC50 (0-72 h) | 0,84 | 0,60 bis 1,03 |
| EbC50 (0-72 h) | 0,53 | 0,20 bis 0,75 |
 |
weiter . |  |
(Stand: 04.08.2022)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: ab 105.- € netto
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion