

 |
zurück |  |
| Bestimmung der Ökotoxizität C.24. Aerobe und Anaerobe Transformation in Wasser/Sediment-Systemen Stand RL 2004/73/EG |
Anhang V zur RL 67/548/EWG |
C.24. 1. Methode
Diese Testmethode entspricht der Prüfrichtlinie OECD TG 308 (2002).
C.24. 1.1 Einleitung
Chemikalien gelangen in flache oder tiefe Oberflächengewässer auf folgenden Wegen: direkte Applikation, Sprühmittelabdrift, Ablauf, Entwässerung, Abfallentsorgung, Industrie-, Haushalts- oder Landwirtschaftsabwässer und über atmosphärische Ablagerung. Die Testmethode beschreibt eine Labormethode zur Beurteilung der aeroben und anaeroben Transformation von organischen Chemikalien in Wasser/Sediment-Systemen. Sie basiert auf bestehenden Richtlinien (1)(2)(3)(4)(5)(6). Auf einem OECD-Workshop zur Boden-/Sedimentauswahl, der 1995 im italienischen Belgirate stattfand (7), wurden insbesondere die Anzahl und Arten der bei diesem Test zu verwendenden Sedimente vereinbart. Des Weiteren gab der Workshop Empfehlungen zur Entnahme, Handhabung und Lagerung von Sedimentproben basierend auf den ISO-Hinweisen (8). Derartige Untersuchungen sind bei Chemikalien erforderlich, bei denen davon auszugehen ist, dass sie unmittelbar in Wasser angewandt werden oder auf den oben aufgeführten Eintragspfaden in den aquatischen Bereich gelangen.
Die Bedingungen in natürlichen Wasser/Sediment-Systemen sind in der oberen Wasserphase häufig aerob. Die Oberflächenschicht des Sediments kann entweder aerob oder anaerob sein, während die tieferen Sedimentschichten in der Regel anaerob sind. Um sämtlichen Möglichkeiten Rechnung zu tragen, werden in diesem Dokument sowohl aerobe als auch anaerobe Tests beschrieben. Der aerobe Test simuliert eine aerobe Wassersäule über einer aeroben Sedimentschicht, die mit einem anaeroben Gradienten unterschichtet ist. Der anaerobe Test simuliert ein vollständig anaerobes Wasser/Sediment-System. Deuten die Umstände darauf hin, dass es notwendig ist, von diesen Empfehlungen deutlich abzuweichen, indem z.B. intakte Sedimentkerne oder Sedimente verwendet werden, die möglicherweise gegenüber der Testsubstanz exponiert waren, können andere, zu diesem Zweck verfügbare Methoden zur Anwendung kommen (9).
C.24. 1.2 Definitionen
In jedem Falle ist das Internationale Einheitensystem (SI-System) anzuwenden.
Testsubstanz: jede Substanz, ob Ausgangsverbindung oder relevante Transformationsprodukte.
Transformationsprodukte: alle Substanzen, die das Ergebnis von biotischen oder abiotischen Transformationsreaktionen der Testsubstanz sind, einschließlich CO2 und Reaktionsprodukte in gebundenen Rückständen.
Gebundene Rückstände: "Gebundene Rückstände" sind Verbindungen in Böden, Pflanzen oder Tieren, die nach einer Extraktion in der Matrix in Form der Ausgangssubstanz oder deren Metaboliten verbleiben. Die Extraktionsmethode darf die Verbindungen selbst oder die Matrixstruktur nicht wesentlich verändern. Die Art der Bindung kann zum Teil durch matrixverändernde Extraktionsmethoden und hochentwickelte Analysenverfahren geklärt werden. Bislang werden z.B. kovalente Ionen- und Sorptionsbindungen sowie Einschlüsse auf diese Weise nachgewiesen. In aller Regel bedeutet die Bildung von gebundenen Rückständen eine deutliche Verminderung der Bioverfügbarkeit (10) [modifiziert nach IUPAC 1984 (11)].
Aerobe Transformation: (oxidierend): in Gegenwart von molekularem Sauerstoff ablaufende Reaktionen (12).
Anaerobe Transformation: (reduzierend): unter Ausschluss von molekularem Sauerstoff ablaufende Reaktionen (12).
Natürliche Gewässer: Oberflächengewässer, die aus Teichen, Flüssen, Strömen usw. stammen.
Sediment: ein Gemisch mineralischer und organisch-chemischer Bestandteile. Letztere enthalten Verbindungen mit hohem Kohlenstoff- und Stickstoffgehalt und mit hoher Molekularmasse . Das Sediment lagert sich in natürlichen Gewässern ab und bildet eine Grenzfläche zu diesem Wasser.
Mineralisation: vollständiger Abbau einer organischen Verbindung zu CO2 und H2O unter aeroben Bedingungen, und zu CH4, CO2 und H2O unter anaeroben Bedingungen. Im Zusammenhang mit dieser Testmethode, bei der eine radioaktiv markierte Verbindung verwendet wird, bedeutet Mineralisation einen extensiven Abbau eines Moleküls, wobei ein markiertes Kohlenstoffatom unter Freisetzung der entsprechenden Menge " CO2 bzw. 14 CH4 quantitativ oxidiert oder reduziert wird .
Halbwertszeit t0,5: die für die 50% ige Transformation einer Testsubstanz ermittelte Zeit, wenn die Transformation mittels Kinetik erster Ordnung beschrieben werden kann; sie ist unabhängig von der Ausgangskonzentration.
Abbauzeit DT50: Zeitspanne, in der sich die Ausgangskonzentration der Testsubstanz um 50 % reduziert hat.
Abbauzeit DT75: Zeitspanne, in der sich die Ausgangskonzentration der Testsubstanz um 75 % reduziert hat.
Abbauzeit DT90: Zeitspanne, in der sich die Ausgangskonzentration der Testsubstanz um 90 % reduziert hat.
C.24. 1.3 Referenzsubstanzen
Referenzsubstanzen sollten zur Identifizierung und Quantifizierung von Transformationsprodukten mittels spektroskopischer und chromatographischer Verfahren verwendet werden.
C.24. 1.4 Informationen zur Testsubstanz
Zur Messung der Transformationsrate kann eine nichtmarkierte oder markierte Testsubstanz verwendet werden, jedoch werden markierte Substanzen bevorzugt. Markierte Substanzen sind notwendig zur Untersuchung des Transformationsweges und zur Aufstellung einer Massenbilanz. Empfohlen wird die 14C-Markierung, doch auch der Einsatz anderer Isotope wie13C,15N,3H oder32P kann sinnvoll sein. Die Markierung sollte möglichst im stabilsten Teil/in den stabilsten Teilen des Moleküls positioniert sein. 1 Die chemische und/oder radiochemische Reinheit der Testsubstanz sollte mindestens 95% betragen.
Vor der Durchführung eines Tests sollten folgende Informationen zur Testsubstanz vorliegen:
Hinweis: Die Temperatur, bei der diese Messungen vorgenommen werden, sollte angegeben werden.
Sinnvoll können u.a. auch folgende Angaben sein: Toxizität der Testsubstanz gegenüber Mikroorganismen, Daten zur leichten und/oder potenziellen biologischen Abbaubarkeit sowie Daten zur aeroben und anaeroben Transformation im Boden.
Analysenmethoden (einschließlich Extraktions- und Reinigungsverfahren) zur Identifizierung und Quantifizierung der Testsubstanz und ihrer Transformationsprodukte in Wasser und Sediment sollten verfügbar sein (siehe Abschnitt 1.7.2).
C.24. 1.5 Prinzip der Testmethode
Bei der hier beschriebenen Methode werden ein aerobes und ein anaerobes Wassersediment verwendet (siehe Anhang 1), das folgende Untersuchungen erlaubt:
Sowohl für die aerobe als auch für die anaerobe Untersuchung sind jeweils mindestens zwei Sedimente sowie die dazugehörigen Wasserphasen erforderlich (7). In bestimmten Fällen sollten jedoch mehr als zwei Sedimente verwendet werden, z.B. bei Chemikalien, die in Binnengewässern und/oder in Meeresgewässern vorkommen können.
C.24. 1.6 Anwendbarkeit des Tests
Die Methode ist allgemein anwendbar auf chemische Substanzen (nichtmarkiert oder markiert), für die ein Analysenverfahren mit hinreichender Genauigkeit und Empfindlichkeit zur Verfügung steht. Es ist anwendbar auf schwach flüchtige, nichtflüchtige, wasserlösliche oder schlecht wasserlösliche Verbindungen. Der Test sollte nicht angewendet werden bei Chemikalien, die aus Wasser stark flüchtig sind (z.B. Begasungsmittel oder organische Lösungsmittel) und somit unter den Versuchsbedingungen dieses Tests nicht im Wasser und/oder Sediment gehalten werden können.
Bisher wird diese Methode zur Untersuchung der Transformation von Chemikalien in Binnengewässern und Sedimenten genutzt, aber im Prinzip ist sie auch für Ästuar-/Meeressysteme anwendbar. Sie ist nicht geeignet zur Simulation von Bedingungen in strömendem Wasser (z.B. Flüssen) oder auf hoher See.
C.24. 1.7 Qualitätskriterien
C.24. 1.7.1 Wiederfindungsraten
Die Extraktion und Analyse von mindestens jeweils zwei parallel angesetzten Wasser- und Sedimentproben unmittelbar nach Zugabe der Testsubstanz geben einen ersten Hinweis auf die Wiederholbarkeit der Analysenmethode und die gleichmäßige Verteilung der Testsubstanz bei der Applikation . Die Wiederfindungsraten für spätere Versuchsphasen ergeben sich aus den jeweiligen Massenbilanzen (bei Verwendung markierter Substanzen). Die Wiederfindungsraten sollten im Bereich von 90-110% für markierte Chemikalien (6) und von 70-110 % für nichtmarkierte Chemikalien liegen.
C.24. 1.7.2 Wiederholbarkeit und Empfindlichkeit der Analysenmethode
Die Wiederholbarkeit der Analysenmethode (ausgenommen die Effizienz der Extraktion im Anfangsstadium) zur Quantifizierung der Testsubstanz und der Transformationsprodukte kann durch eine parallele Analyse desselben Extrakts der Wasser- bzw. der Sedimentproben, die hinreichend lange zur Bildung von Transformationsprodukten inkubiert wurden, überprüft werden.
Die Nachweisgrenze ("limit of detection; LOD") der Analysenmethode für die Testsubstanz und für die Transformationsprodukte sollte mindestens 0,01 mg×kg in Wasser oder Sediment (als Testsubstanz) oder - falls dieser Wert niedriger ist - 1% der in ein Testsystem applizierten Ausgangsmenge betragen. Die Quantifizierungsgrenze ("limit of quantification; LOQ") sollte ebenfalls spezifiziert werden.
C.24. 1.7.3 Genauigkeit der Transformationsdaten
Geeignete Informationen über die Zuverlässigkeit der Transformationskurve lassen sich mittels einer Regressionsanalyse aus den Testsubstanzkonzentrationen in Abhängigkeit von der Zeit gewinnen, die auch die Berechnung des Vertrauensbereiche für Halbwertszeiten (im Falle einer Kinetik pseudo-erster Ordnung) bzw. DT50-Werte und ggf. für DT75- und DT90-Werte ermöglicht.
C.24. 1.8 Beschreibung der Methode
C.24. 1.8.1 Testsystem und Geräte
Die Untersuchung sollte in Glasgefäßen (z.B. Flaschen oder Zentrifugengläsern) durchgeführt werden, sofern nicht bereits vorliegende Informationen (wie der n-Octanol/Wasser-Verteilungskoeffizient, Sorptionsdaten usw.) darauf hindeuten, dass die Testsubstanz möglicherweise an Glas anhaftet. In diesem Fall kann es erforderlich sein, andere Materialien (wie Teflon) in Betracht zu ziehen. Wenn bekannt ist, dass die Testsubstanz an Glas anhaftet, könnte eine Lösung darin bestehen, eine oder mehrere der folgenden Methoden anzuwenden:
Bestimmung der Masse der am Glas sorbierten Testsubstanz und Transformationsprodukte; Obligatorische Spülung aller Glasgegenstände mit einem Lösungsmittel zu Testende; Verwendung formulierter Handelsprodukte (siehe auch Abschnitt 1.9.2);
Verwendung einer größeren Menge eines Hilfslösungsmittels für die Zugabe der Testsubstanz in das System; das eingesetzte Hilfslösungsmittel sollte die Testsubstanz nicht durch Solvolyse aufspalten.
Beispiele für typische Testgeräte, d. h. Durchfluss- und Biometersysteme, sind in Anhang 2 bzw. 3 dargestellt (14). Weitere geeignete Inkubationssysteme sind in der Literaturangabe 15 beschrieben. Die Anordnung der Versuchsgeräte sollte den Austausch von Luft oder Stickstoff und das Auffangen flüchtiger Produkte ermöglichen. Die Geräte müssen so bemessen sein, dass sie den Anforderungen des Tests entsprechen (siehe Abschnitt 1.9.1). Die Belüftung kann entweder durch schonendes Durchperlen oder durch das Leiten von Luft oder Stickstoff über die Wasseroberfläche erfolgen. Im letzteren Fall kann ein vorsichtiges Umrühren des Wassers von oben angeraten sein, um eine bessere Verteilung des Sauerstoffs bzw. Stickstoffs im Wasser zu erreichen. CO2-freie Luft sollte nicht verwendet werden, da dies zu einem Anstieg des pH-Werts des Wassers führen kann. In jedem Falle ist eine Störung des Sediments nicht wünschenswert und sollte weitestgehend vermieden werden. Schwach flüchtige Chemikalien sollten in einem Biometersystem unter vorsichtigem Rühren der Wasseroberfläche getestet werden. Ebenfalls können geschlossene Gefäße mit einer Gasphase aus atmosphärischer Luft oder Stickstoff sowie mit innen befindlichen Röhrchen zum Auffangen flüchtiger Produkte verwendet werden (16). Beim aeroben Test ist ein regelmäßiger Austausch der Gasphase im oberen Teil des Gefäßes erforderlich, um den Sauerstoffverbrauch durch die Biomasse auszugleichen.
Geeignete Abscheider für das Sammeln flüchtiger Transformationsproduktesind u. a. Kaliumhydroxid- oder Natriumhydroxidlösungen (1 mol×dm-3) für Kohlendioxid 2 und Ethylenglykol, Ethanolamin oder 2%iges Paraffin in Xylol für organische Verbindungen. Flüchtige Verbindungen wie Methan, die unter anaeroben Bedingungen entstehen, können z.B. mittels Molekularsieben aufgefangen werden. Solche flüchtigen Verbindungen können z.B. zu CO2 verbrannt werden, indem das Gas bei einer Temperatur von 900 °C durch eine CuO enthaltende Quarzröhre geführt und das gebildete CO2 in einem Abscheider mit Alkali aufgefangen wird (17).
Erforderlich ist eine Laborausstattung für die chemische Analyse der Testsubstanz und von Transformationsprodukten (z.B. Gasflüssig-Chromatographie (GLC), Hochleistungsflüssigchromatographie (HPLC), Dünnschichtchromatographie (TLC), Massenspektroskopie (MS), Gaschromatographie-Massenspektroskopie (GC-MS), Flüssigchromatographie-Massenspektrometrie (LC-MS), kernmagnetische Resonanz (NMR) u. a.), sowie ggf. Detektionssysteme für radioaktiv markierte oder nichtmarkierte Chemikalien. Bei Verwendung radioaktiv markierter Substanzen werden darüber hinaus ein Flüssigkeitsszintillationszähler und ein Oxidationsmittel (für die Verbrennung von Sedimentproben vor der Analyse auf Radioaktivität) benötigt.
Weitere Standardlaborgeräte für physikalisch-chemische und biologische Bestimmungen (siehe Tabelle 1, Abschnitt 1.8.2.2), Glasgegenstände, Chemikalien und Reagenzien sind je nach Bedarf erforderlich.
C.24. 1.8.2 Auswahl und Anzahl von Wassersedimenten
Die Probenahmestellen sollten entsprechend dem Zweck des Tests je nach gegebener Situation gewählt werden. Bei der Auswahl der Probenahmestellen ist die Vorgeschichte möglicher landwirtschaftlicher, industrieller oder häuslicher Einträge in das Einzugsgebiet und die Oberläufe zu berücksichtigen. Es sollten nur Sedimente verwendet werden, die in den 4 vorhergehenden Jahren nicht mit der Testsubstanz oder ihren Struktur-Analoga verunreinigt worden sind.
C.24. 1.8.2.1 Sedimentauswahl
Für die aeroben Tests werden üblicherweise zwei Sedimente verwendet (7). Die beiden ausgewählten Sedimente sollten sich hinsichtlich ihres organischen Kohlenstoffgehalts und ihrer Textur voneinander unterscheiden. Ein Sediment sollte einen hohen organischen Kohlenstoffgehalt (2,5 - 7,5 %) aufweisen und feinkörnig sein, das andere Sediment sollte einen niedrigen organischen Kohlenstoffgehalt (0,5 - 2,5 %) haben und grobkörnig sein. Der Unterschied zwischen den organischen Kohlenstoffgehalten sollte im Regelfall mindestens 2 % betragen. "Feinkörnigkeit" wird definiert als ein [Ton und Schluff] 3-Gehalt von > 50 %l und "Grobkörnigkeit" wird definiert als ein [Ton und Schluff]-Gehalt von < 50 %. Die Differenz zwischen den [Ton und Schluff]-Gehalten beider Sedimente sollte in aller Regel mindestens 20 % betragen. In Fällen, in denen eine Chemikalie auch in Meerwasser gelangen kann, sollte mindestens eines der Wasser/Sediment-Systeme marinen Ursprungs sein .
Für die strikt anaerobe Untersuchung sollten Proben von zwei Sedimenten (einschließlich des jeweils dazugehörigen Wassers) aus den anaeroben Bereichen der Oberflächenwasserkörper genommen werden (7). Handhabung und Transport von Sediment- und Wasserphasen sollten vorsichtig unter Ausschluss von Sauerstoff erfolgen.
Für die Auswahl von Sedimenten können noch andere Parameter von Bedeutung sein und sollten je nach Ausgangslage berücksichtigt werden. So wäre z.B. der pH-Bereich von Sedimenten wichtig für die Untersuchung von Chemikalien, bei denen die Transformation und/oder Sorption pH-abhängig sein könnte . Die pH-Abhängigkeit der Sorption kann im pKa-Wert der Testsubstanz zum Ausdruck kommen.
C.24. 1.8.2.2 Charakterisierung von Wasser-Sediment-Proben
In der folgenden Tabelle sind die wichtigsten Parameter, die für Wasser und Sediment zu messen und zu protokollieren sind (unter Verweis auf die verwendete Methode) sowie die Testphase, in der diese Parameter zu bestimmen sind, aufgeführt. Informationen über die Methoden zur Bestimmung dieser Parameter sind in der Literatur (18)(19)(20)(21) zu finden.
Unter Umständen sind je nach Ausgangslage noch weitere Parameter zu messen und zu protokollieren (z.B. für Süßwasser: Partikel, Alkalinität, Härte, Leitfähigkeit, NO3/PO4 (Verhältnis und Einzelwerte); für Sedimente: Kationenaustauschkapazität, Wasserhaltekapazität, Carbonat, Gesamtstickstoff und -phosphor; und für Meeressysteme: Salzgehalt). Zur Messung der Redoxbedingungen, insbesondere im Hinblick auf die anaerobe Transformation, kann auch eine Analyse von Sedimenten und Wasser auf Nitrat, Sulfat, bioverfügbares Eisen und evtl. andere Elektronenakzeptoren sinnvoll sein.
Messung von Parametern zur Charakterisierung von Wasser/Sediment-Proben (7)(22)(23)
| Parameter | Phase des Testverfahrens | |||||
| Feldprobenahme | Handhabung | Beginn der Akklimatisierung | Testbeginn | laufender Test | Testende | |
| Wasser | ||||||
| Herkunft/Quelle | x | |||||
| Temperatur | x | |||||
| pH-Wert | x | x | x | x | x | |
| TOC | x | x | x | |||
| O2-Konzentration* | x | x | x | x | x | |
| Redoxpotenzial* | x | x | x | x | ||
| Sediment | ||||||
| Herkunft/Quelle | x | |||||
| Tiefe der Schicht | x | |||||
| pH-Wert | x | x | x | x | x | |
| Korngrößenverteilung | x | |||||
| TOC | x | x | x | x | ||
| Mikrobielle Biomasse** | x | x | x | |||
| Redoxpotenzial * | Beobachtungb (Farbe /Geruch) | x | x | x | x | |
| *) Aktuelle Forschungsergebnisse haben gezeigt, dass Messungen der Sauerstoffkonzentrationen im Wasser und der Redoxpotenziale für das Wachstum und die Entwicklung von mikrobiellen Populationen in Oberflächengewässern weder einen mechanistischen noch einen prognostischen Wert besitzen (24)(25). Zur Interpretation und Beurteilung der aeroben biologischen Transformationsraten und -pfade besser geeignete Hilfsmittel sind möglicherweise die Bestimmung des Biochemischen Sauerstoffbedarfs (BSB bei der Feldprobenahme sowie zu Testbeginn und -ende ) und die Konzentrationsbestimmung der Mikro-/Makronährstoffe Car2+, Mg2+ und Mn2+ (zu Testbeginn und -ende ) in Wasser sowie die Messung des Gesamt-N und Gesamt-P in Sedimenten (bei der Feldprobenahme und zu Testende).
**) Die Methode der mikrobiellen Respirationsrate (26), die Fumigationsmethode (27) oder die Bestimmung der Lebendkeimzahl (z.B. Bakterien, Aktinomyceten, Pilze und Gesamtzahl der Kolonien) für aerobe Untersuchungen; Methanogeneserate bei anaeroben Untersuchungen. |
||||||
C.24. 1.8.3 Probenahme, Handhabung und Lagerung
C.24. 1.8.3.1 Probenahme
Für die Entnahme von Sedimentproben sollte der Entwurf der ISO-Hinweise zur Probenahme von Sedimenten (8) herangezogen werden. Sedimentproben sollten von der gesamten oberen, 5 bis 10 cm starke Sedimentschicht genommen werden. Am selben Standort und zum selben Zeitpunkt sollte das dazugehörige Wasser entnommen werden. Für die anaerobe Studie sollte die Probenahme und der Transport des Sedimentes und des dazugehörigen Wassers unter Ausschluss von Sauerstoff erfolgen (28)(siehe Abschnitt 1.8.2.1). Einige Probenahmegeräte sind in der Literatur beschrieben (8)(23).
C.24. 1.8.3.2 Handhabung
Das Sediment wird durch Filtration vom Wasser getrennt und dann mit überschüssigem Standortwasser, das anschließend verworfen wird, durch ein Sieb mit einer Maschenweite von 2 mm feuchtgesiebt. Dann werden bekannte Mengen Sediment und Wasser im gewünschten Verhältnis (siehe Abschnitt 1.9.1) in Inkubationsgefäßen vermischt und für die Akklimatisierung vorbereitet (siehe Abschnitt 1.8.4). Bei der anaeroben Studie sind alle Schritte unter Ausschluss von Sauerstoff durchzuführen (29)(30)(31)(32)(33).
C.24. 1.8.3.3 Lagerung
In jedem Falle wird die Verwendung frischer Sediment- und Wasserproben empfohlen; ist jedoch eine Lagerung erforderlich, sollten Sediment und Wasser wie zuvor beschrieben gesiebt und zusammen gelagert werden, und zwar mit einem Wasserüberstand (6-10 cm Wassersäule), im Dunkeln, bei 4 ± 2 °C 4 und für einen Zeitraum von höchstens 4 Wochen (7)(8)(23). Für aerobe Untersuchungen vorgesehene Proben sollten bei freiem Luftzutritt gelagert werden (z.B. in offenen Behältern), die für anaerobe Untersuchungen vorgesehenen Proben hingegen unter Ausschluss von Sauerstoff. Während des Transports und der Lagerung dürfen Sediment und Wasser nicht gefrieren und das Sediment darf nicht austrocknen.
C.24. 1.8.4 Vorbereitung der Sediment-/Wasserproben für den Test
Der Testsubstanzzugabe sollte eine Akklimatisierungsperiode vorangehen, während der sich jede Sediment-/Wasserprobe in dem im Haupttest zu verwendenden Inkubationsgefäß befindet. Die Bedingungen der Akklimatisierungsperiode müssen exakt denen der Inkubation beim Haupttest entsprechen (siehe Abschnitt 1.9.1). Die Akklimatisierungsperiode ist die Zeit, die benötigt wird, um eine hinreichende Stabilität des Systems zu erreichen, die sich am pH-Wert, an der Sauerstottkonzentration im Wasser, am Redoxpotenzial des Sedimentes und Wassers sowie an der mikroskopischen Phasentrennung ablesen lässt. Die Akklimatisierungsperiode beträgt in aller Regel ein bis zwei Wochen und sollte vier Wochen nicht überschreiten. Die Ergebnisse der während dieser Zeit durchgeführten Bestimmungen sind zu protokollieren.
C.24. 1.9 Durchführung des Tests
C.24. 1.9.1 Testbedingungen
Der Test sollte im Inkubationsgefäß (siehe Abschnitt 1.8.1) mit einem Wasser/Sediment-Volumenverhältnis zwischen 3:1 und 4:1 und einer Sedimentschicht von 2,5 cm (± 0,5 cm) durchgeführt werden. 2 Eine Mindestmenge von 50 g Sediment (Trockengewicht) pro Inkubationsgefäß wird empfohlen.
Der Test sollte im Dunkeln bei einer konstanten Temperatur im Bereich von 10 bis 30 °C durchgeführt werden. Angemessen ist eine Temperatur von (20 ± 2) °C. Falls notwendig, kann zusätzlich eine niedrigere Temperatur (im allgemeinen 10 °C) gewählt werden, als Einzelfallentscheidung in Abhängigkeit von den zu ermittelnden Testergebnissen.. Die Inkubationstemperatur sollte überwacht und protokolliert werden.
C.24. 1.9.2 Behandlung und Applikation der Testsubstanz
Es wird eine Testkonzentration der Chemikalie verwendet 5. Für Pflanzenschutzmittel, die direkt auf den Wasserkörper appliziert werden, sollte die auf dem Etikett angegebene Höchstdosierung als maximale Applikationsrate, die bezogen auf die Wasseroberfläche des Testgefäßes errechnet wird, eingesetzt werden. In allen anderen Fällen sollte die einzusetzende Konzentration auf Berechnungen aus Umweltemissionen basieren. Es ist darauf zu achten, dass eine ausreichende Testsubstanzkonzentration appliziert wird, um den Transformationspfad und die Bildung und den Rückgang der Transformationsprodukte erfassen zu können. Es kann erforderlich sein, höhere Dosen zu applizieren (z.B. das Zehnfache), wenn z.B. die Testsubstanzkonzentration zu Testbeginn dicht an der Nachweisgrenze liegt und/oder wenn die Haupttransformationsprodukte nicht ohne weiteres nachgewiesen werden können, obwohl ihr Anteil 10 % der Applikationsrate der Testsubstanz ausmacht. Werden höhere Testkonzentrationen verwendet, sollten diese allerdings keine erhebliche Beeinträchtigung der mikrobiellen Aktivität des Wasser/Sediment-Systems bewirken. Um eine konstante Testsubstanzkonzentration in verschieden großen Gefäßen zu erreichen, kann eine Anpassung der applizierten Substanzmenge als sinnvoll angesehen werden, basierend auf der Höhe der Wassersäule im Gefäß im Verhältnis zur Höhe der Wassersäule am Probenahmestandort (die mit 100 cm angenommen wird, doch auch andere Höhen sind möglich). Siehe die Beispielrechnung in Anhang 4.
Idealerweise sollte die Testsubstanz als wässrige Lösung in die Wasserphase des Testsystems gegeben werden. Falls es sich nicht vermeiden lässt, ist der Einsatz geringer Mengen von mit Wasser mischbaren Lösungsmitteln (wie Aceton oder Ethanol) für die Applikation und Verteilung der Testsubstanz zulässig, sollte jedoch 1 % v/v nicht überschreiten und die mikrobielle Aktivität des Testsystems nicht beeinträchtigen. Die Herstellung der wässrigen Lösung der Testsubstanz ist mit Sorgfalt vorzunehmen - zur Sicherstellung einer vollständigen Homogenität kann die Verwendung von Generatorsäulen und das Mischen vor Testbeginn sinnvoll sein. Nach Zugabe der wässrigen Lösung in das Testsystem wird ein vorsichtiges Mischen der Wasserphase empfohlen, wobei das Sediment so wenig wie möglich gestört werden sollte.
Die Verwendung von formulierten Handelsprodukten wird routinemäßig nicht empfohlen, da die Formulierungsbestandteile die Verteilung der Testsubstanz und/oder der Transformationsprodukte zwischen der Wasser- und der Sedimentphase beeinflussen können. Bei schlecht wasserlöslichen Testsubstanzen kann der Einsatz von formulierten Handelsprodukten jedoch eine geeignete Alternative darstellen.
Die Anzahl der Inkubationsgefäße richtet sich nach der Anzahl der Probenahmezeitpunkte (siehe Abschnitt 1.9.3). Es sollte eine ausreichende Anzahl von Testansätzen vorgesehen werden, so dass zwei Ansätze zu jedem Probenahmezeitpunkt ausgewertet werden können. Werden Kontrollansätze für die verschiedenen Wasser/Sediment-Systeme eingesetzt, sollten sie nicht mit der Testsubstanz behandelt werden. Die Kontrollansätze können zur Bestimmung der mikrobiellen Biomasse des Sediments und der Gesamtmenge an organisch gebundenem Kohlenstoff des Wassers und Sedimentes zu Testende herangezogen werden. Zwei der Kontrollansätze (d. h. ein Kontrollansatz pro Wassersedimentansatz) können zur Überwachung der erforderlichen Parameter im Sediment und im Wasser während der Akklimatisierungsphase genutzt werden (siehe Tabelle in Abschnitt 1.8.2.2). Es sind zwei zusätzliche Kontrollansätze für den Fall vorzusehen, dass die Testsubstanz mittels eines Lösungsmittels appliziert wird, um Beeinträchtigungen der mikrobiellen Aktivität des Testsystems zu erfassen.
C.24. 1.9.3 Testdauer und Probenahme
Der Versuch sollte im Normalfall nicht länger als 100 Tage dauern (6) und sollte jedoch solange fortgesetzt werden, bis der Abbauweg und das Wasser-/Sedimentverteilungsmuster ermittelt sind bzw. der Verlust der Testsubstanz durch Transformation und/oder Verflüchtigung 90 % erreicht hat. Die Anzahl der Probenahmezeitpunkte sollte mindestens sechs (einschließlich des Nullzeitpunkts) betragen, wobei fakultativ eine Voruntersuchung (siehe Abschnitt 1.9.4) durchgeführt werden kann, um ein geeignetes Probenahmeschema und die optimale Testdauer zu ermitteln, sofern nicht genügend Daten zur Testsubstanz aus früheren Untersuchungen vorliegen. Bei hydrophoben Testsubstanzen können zusätzliche Probenahmen während der Anfangsphase der Untersuchung erforderlich sein, um die Verteilungsrate zwischen der Wasser-/Sedimentphase zu bestimmen.
Zu entsprechenden Probenahmezeitpunkten werden komplette Inkubationsgefäße (im Replikat) zur Analyse entnommen. Das Sediment und das darüber liegende Wasser werden getrennt analysiert 6. Das Oberflächenwasser sollte vorsichtig entnommen werden, um das Sediment so wenig wie möglich zu stören. Die Extraktion und Charakterisierung der Testsubstanz und der Transformationsprodukte sollte nach geeigneten Analysenverfahren erfolgen. Substanzen, die sich unter Umständen am Inkubationsgefäß oder an den Verbindungsleitungen, die zum Auffangen flüchtiger Verbindungen dienen, angelagert haben, sollten vorsichtig abgelöst und gesammelt werden.
C.24. 1.9.4 Fakultative Voruntersuchung
Können Dauer und Probenahmeschema nicht auf der Grundlage anderer relevanter Untersuchungen zur Testsubstanz abgeschätzt werden, kann fakultativ eine Voruntersuchung als sinnvoll angesehen werden, die unter den gleichen Testbedingungen durchzuführen ist, wie sie für den endgültigen Hauptversuch geplant sind. Die relevanten Versuchsbedingungen und Ergebnisse aus der Voruntersuchung, falls sie durchgeführt wurde, sollten in Kurzform protokolliert werden.
C.24. 1.9.5 Messungen und Analyse
Die Konzentration der Testsubstanz und der Transformationsprodukte ist zu jedem Probenahmezeitpunkt im Wasser und im Sediment zu messen und zu protokollieren (als Konzentrationsangabe und als prozentualer Anteil der Applikationsmenge). Allgemein sollten Transformationsprodukte, die 10% der applizierten Radioaktivität im gesamten Wasser/Sediment-System zu irgendeinem Probenahmezeitpunkt aufweisen, identifiziert werden, sofern nicht hinreichende Gründe dagegen sprechen. Ebenfalls für eine Identifizierung in Betracht gezogen werden sollten Transformationsprodukte, deren Konzentrationen während des Tests kontinuierlich steigen, da dies ein Hinweis auf Persistent ist, auch wenn ihre Konzentrationen die o.g. Grenzen nicht überschreiten. Dieses Vorgehen sollte im Einzelfall erwogen und im Abschlussbericht begründet werden.
Zu jedem Probenahmezeitpunkt sollten die Ergebnisse aus den Abscheidesystemen für Gase/flüchtige Verbindungen (CO2 und andere, d.h. flüchtige organische Verbindungen) protokolliert werden. Die Mineralisationsraten sind zu protokollieren. Nichtextrahierbare (gebundene) Rückstände im Sediment sind zu jedem Probenahmezeitpunkt zu protokollieren.
C.24. 2 Daten
C.24. 2.1 Aufbereitung der Ergebnisse
Die Gesamtmassenbilanz bzw. die Wiederfindungsrate (siehe Abschnitt 1.7.1) der zugegebenen Radioaktivität ist zu jedem Probenahmezeitpunkt zu berechnen. Die Ergebnisse sind als Anteile (in %) der applizierten Radioaktivität zu protokollieren. Die Verteilung der Radioaktivität im Wasser und Sediment sollte als Konzentration und prozentualer Anteil zu jedem Probenahmezeitpunkt protokolliert werden.
Die Halbwertszeit, DT50- und ggf. DT75- und DT90-Werte der Testsubstanz sollten zusammen mit ihren Vertrauensbereichen berechnet werden (siehe Abschnitt 1.7.3). Informationen zur Verlustrate der Testsubstanzkonzentration im Wasser und im Sediment lassen sich mittels geeigneter Berechnungsprogramme gewinnen. Dazu können gehören: die Anwendung einer Kinetik nach pseudo-erster Ordnung, empirische Kurvenanpassungsverfahren unter Anwendung graphischer oder numerischer Lösungen sowie komplexere Berechnungen z.B. unter Anwendung von Einzel- oder Mehrkompartimentmodellen. Weitere Einzelheiten sind in der relevanten Literatur zu finden (35)(36)(37).
Alle Ansätze haben Stärken und Schwächen und weisen hinsichtlich ihrer Komplexität erhebliche Unterschiede auf. Die Annahme einer Kinetik erster Ordnung kann eine zu starke Vereinfachung der Abbau- und Verteilungsprozesse bedeuten, ergibt jedoch - falls möglich - ein Wert (die Geschwindigkeitskonstante oder Halbwertszeit), der leicht zu verstehen und für Simulationsmodellierungen und Berechnungen von Umweltkonzentrationen relevant ist. Empirische Ansätze oder lineare Transformationen können bessere Anpassungen von Kurven an Daten und damit eine optimalere Abschätzung von Halbwertszeiten, DT50- und ggf. DT75- und DT90-Werten ermöglichen. Allerdings ist der Nutzen dieser abgeleiteten Konstanten begrenzt. Mit Kompartimentmodellen lassen sich eine Reihe nützlicher Konstanten berechnen, die wichtig für die Risikoabschätzung sind und die die Abbaugeschwindigkeit in den verschiedenen Kompartimenten, sowie die Verteilung der Chemikalie beschreiben. Sie sollten ferner zur Ermittlung der Geschwindigkeitskonstanten für die Bildung und den Abbau von Haupttransformationsprodukten herangezogen werden. In allen Fällen muss die Auswahl der Methode begründet werden und der Versuchsleiter sollte die Güte der Anpassung graphisch und/oder statistisch nachweisen.
C.24. 3 Abschlussbericht
C.24. 3.1 Testbericht
Der Testbericht muss folgende Angaben enthalten: Testsubstanz:
Referenzsubstanzen:
Testsedimente und -wasser:
Testbedingungen:
Ergebnisse:
C.24. 4 Literaturangaben
(1) BBA-Guidelines for the examination of plant protectors in the registration process. (1990). Part IV, Section 5-1: Degradability and fate of plant protectors in the water/sediment System. Germany.
(2) Commission for registration of pesticides: Application for registration of a pesticide. (1991). Part G. Behaviour of the product and its metabolites in soll, water and air, Section G.2.1 (a). The Netherlands.
(3) MAFF Pesticides Safety Directorate. (1992). Preliminary guideline for the conduct of biodegradability tests on pesticides in natural Sediment/water Systems. Ref No SC 9046. United-Kingdom.
(4) Agriculture Canada: Environmental chemistry and fate. (1987). Guidelines for registration of pesticides in Canada. Aquatic (Laboratory) - Anaerobic and aerobic. Canada. pp 35-37.
(5) US-EPA: Pesticide assessment guidelines, Subdivision N. Chemistry: Environmental fate (1982). Section 162-3, Anaerobic aquatic metabolism.
(6) SETAC-Europe publication. (1995). Procedures for assessing the environmental fate and ecotoxicity of pesticides. Ed. Dr Mark R. Lynch. SETAC-Europe, Brussels.
(7) OECD Test Guidelines Programme. (1995). Final Report of the OECD Workshop on Selection of Soils/sediments, Belgirate, Italy, 18-20 January 1995.
(8) ISO/DIS 5667-12. (1994). Water quality - Sampling - Part 12: Guidance on sampling of bottom Sediments.
(9) US-EPa (1998a). Sediment/water microcosm biodegradation test. Harmonised Test Guidelines (OPPTS 835.3180). EPa 712-C-98-080.
(10) DFG: Pesticide Bound Residues in Soil. Wiley-VCH (1998).
(11) T.R. Roberts: Non-extractable pesticide residues in soils and plants. Pure Appl. Chem. 56, 945-956 (IUPAC 1984).
(12) OECD Test Guideline 304A: Inherent Biodegradability in Soll (adopted 12 May 1981).
(13) OECD (1993): Guidelines for Testing of Chemicals. Paris. OECD (1994-2000): Addenda 6-11 to Guidelines for the Testing of Chemicals.
(14) Scholz, K., Fritz R., Anderson C. and Spiteller M. (1988) Degradation of pesticides in an aquatic mode) ecosystem. BCPC - Pests and Diseases, 3B-4, 149-158.
(15) Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soil. In Progress in Pesticide Biochemistry (D.H. Hutson, T.R. Roberts, Eds.), Vol. 1, 85-114. J. Wiley & Sons.
(16) Madsen, T., Kristensen, P. (1997). Effects of bacterial inoculation and non-ionic surfactants an degradation of polycyclic aromatic hydrocarbons in soil. Environ. Toxicol. Chem. 16, 631-637.
(17) Steber, J., Wierich, P. (1987). The anaerobic degradation of detergent range fatty alcohol ethoxylates. Studies with "C-labelled model surfactants. Water Research 21, 661-667.
(18) Black, C.A. (1965). Methods of Soil Analysis. Agronomy Monograph No. 9. American Society of Agronomy, Madison.
(19) APHa (1989). Standard Methods for Examination of Water and Wastewater (17`h edition). American Public Health Association, American Water Works Association and Water Pollution Control Federation, Washington D.C.
(20) Rowell, D.L. (1994). Soil Science Methods and Applications. Longman.
(21) Light, T.S. (1972). Standard solution for redox potential measurements. Anal. Chemistry 44, 1038-1039.
(22) SETAC-Europe publication (1991). Guidance document on testing procedures for pesticides in freshwater mesocosms. From the Workshop "a Meeting of Experts on Guidelines for Static Field Mesocosms Tests", 3-4 July 1991.
(23) SETAC-Europe publication. (1993). Guidance document on Sediment toxicity tests and bioassays for freshwater and marine environments. From the Workshop On Sediment Toxicity Assessment (WOSTA), 8-10 November 1993. Eds.: I.R. Hill, P. Matthiessen and F. Heimbach.
(24) Vink, J.P.M., van der Zee, S.E.A.T.M. (1997). Pesticide biotransformation in surface waters: multivariate analyses of environmental factors at field sites. Water Research 31, 2858-2868.
(25) Vink, J.P.M., Schraa, G., van der Zee, S.E.A.T.M. (1999). Nutrient effects on microbial transformation of pesticides in nitrifying waters. Environ. Toxicol, 329-338.
(26) Anderson, T.H., Domsch, K.H. (1985). Maintenance carbon requirements of actively-metabolising microbial populations under in-sitz,' conditions. Soil Biol. Biochem. 17, 197-203.
(27) ISO-14240-2. (1997). Soil quality - Determination of soil microbial biomass - Part 2: Fumigationextraction method.
(28) Beelen, P. Van and F. Van Keulen. (1990), The Kinetics of the Degradation of Chloroform and Benzene in Anaerobic Sediment from the River Rhine. Hydrobiol. Bull. 24 (1), 13-21.
(29) Shelton, D.R. and Tiedje, J.M. (1984). General method for determining anaerobic biodegradation potential. App. Environ. Microbiol. 47, 850-857.
(30) Birch, R.R., Biver, C., Campagna, R., Gledhill, W.E., Pagga, U., Steber, J., Reust, H. and Bontinck, W.J. (1989). Screening of chemicals for anaerobic biodegradation. Chemosphere 19, 1527-1550.
(31) Pagga, U. and Beimborn, D.B. (1993). Anaerobic biodegradation tests for organic compounds. Chemoshpere 27, 1499-1509.
(32) Nuck, B.A. and Federle, T.W. (1986). a batch test for assessing the mineralisation of "C-radiolabelled compounds under realistic anaerobic conditions. Environ. Sc'. Technol. 30, 3597-3603.
(33) US-EPa (19986). Anaerobic biodegradability of organic chemicals. Harmonised Test Guidelines (OPPTS 835.3400). EPa 712-C-98-090.
(34) Sijm, Haller and Schrap (1997). Influence of storage on sediment characteristics and drying sediment on sorption coefficients of organic contaminants. Bulletin Environ. Contam. Toxicol. 58, 961-968.
(35) Timme, G., Frehse H. and Laska V. (1986) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues II. Pflanzenschutz - Nachrichten Bayer, 39, 187 - 203.
(36) Timme, G., Frehse, H. (1980) Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues 1. Pflanzenschutz - Nachrichten Bayer, 33, 47 - 60.
(37) Carlton, R.R. and Allen, R. (1994). The use of a compartment model for evaluating the fate of pesticides in sediment/water Systems. Brighton Crop Protection Conference - Pest and Diseases, pp 1349-1354.
Anhang 1
Anleitung zu den Aeroben und den Anaeroben Testsystemen
Aerobes Testsystem
Das in dieser Testmethode beschriebene aerobe Testsystem besteht aus einer aeroben Wassersäule (typische Sauerstoffkonzentrationen im Bereich von 7 bis 10 mg×l-1) und einer Sedimentschicht, die an der Oberfläche aerob und unter der Oberfläche anaerob ist (typische mittlere Redoxpotenziale (Eh) der anaeroben Sedimentzone liegen im Bereich von -80 bis -190 mV). In jedem Inkubationsgefäß wird angefeuchtete Luft über die Wasseroberfläche geführt, um im oberen Teil des Gefäßes eine ausreichende Menge Sauerstoff zu gewährleisten.
Anaerobes Testsystem
Das Testverfahren des anaeroben Testsystems gleicht im Wesentlichen dem für das aerobe System beschriebenen, mit dem Unterschied, dass in jedem Inkubationsgefäß angefeuchteter Stickstoff über die Wasseroberfläche geführt wird, um eine ausreichende Stickstoffmenge im oberen Gefäßteil zu gewährleisten. Sediment und Wasser werden als anaerob betrachtet, wenn das Redoxpotenzial (Eh) niedriger ist als -100 mV.
Im anaeroben Test beruht die Beurteilung der Mineralisation auf der Messung des gebildeten Kohlendioxids und Methans.
Anhang 2
Beispiel eines Durchflusssystems
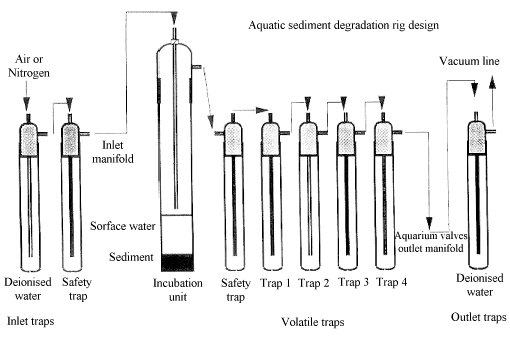 |
Legend (Anhang 2)
Inlet traps: Zuleitungsabscheider Surface water: Oberflächenwasser Incubation unit: Inkubationsgefäß Deionised water: deionisiertes Wasser Inlet manifold: Zufluß Sediment: Sediment Safety trap: Sicherheitsabscheider Volatile trap: Abscheider für flüchtige Produkte Acqualic sediment degradation: Wasser/Sediment Abbau Rig design: Versuchsaufbau Outlet manifold: Abfluß Outlet traps: Abflußabscheider Aquarium valves: Ventil Vacuum line: Vakuumleitung |
Sicherheitsabscheider, leer Abscheider 1: Ethylenglykol für die Abscheidung flüchtiger organischer Stoffe Abscheider 2: 0,1M Schwefelsäure für die Abscheidung flüchtiger alkalischer Stoffe Abscheider 3 und 4: 2M Natriumhydroxid für die Abscheidung von CO2 und anderen flüchtigen sauren Stoffen |
|
Anhang 3
Beispiel eines Biometersystems
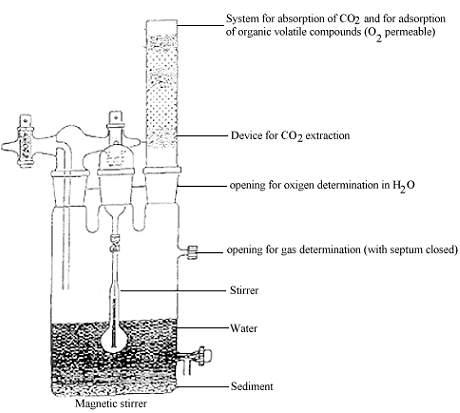
Legend (Anhang 3)
System for absorption q/ CO2 and,/rar adsorption q/ volatile compounds (O2 permeable): System zur Absorption von CO2 und zur Adsorption flüchtiger Verbindungen (sauerstoffdurchlässig)
Device for CO2 extraction: Gerät zur CO2-Abscheidung
Opening for oxygen determination in 1120: Öffnung zur Sauerstoffbestimmung im Wasser
Opening for gas determination (wich septum closed): Öffnung zur Gasbestimmung (mit geschlossenem Septum) Magnetic stirrer: Magnetrührer
Anhang 4
Beispielrechnung für die Applikationsdosis in Testgefässen
| Zylinderinnendurchmesser: | = 8 cm |
| Höhe der Wassersäule ohne Sediment: | = 12 cm |
| Oberfläche: 3,142 x 42 | = 50,3 cm2 |
| Applikationsrate: 500 g Testsubstanz/ha entspricht 5 µg/cm2
Gesamtmenge [µg]: 5 x 50,3 |
= 251,5 µg |
| Bezug der Gesamtmenge auf eine Wassersäulenhöhe von 100 cm: 12 x 251,5 = 100 |
= 30,18 µg |
| Volumen der Wassersäule: 50,3 x 12 | = 603 ml |
| Konzentration in Wasser: 30,18 = 603 | = 0,050 µg/ml oder 50 µg/l |
____________________
1) Wenn beispielsweise die Testsubstanz einen Ring enthält, muss sich die Markierung auf diesem Ring befinden; enthält die Testsubstanz zwei oder mehr Ringe, können gesonderte Untersuchungen erforderlich sein, um den Verbleib jedes markierten Rings zu erfassen und sachgerechte Informationen zur Bildung von Transformationsprodukten zu gewinnen.
2) Da diese basischen Absorptionslösungen auch das Kohlendioxid aus der Belüftungsluft und das bei den aeroben Versuchen durch die Atmung gebildete Kohlendioxid absorbieren können, müssen sie in regelmäßigen Zeitabständen ausgewechselt werden, um ihre Sättigung und damit einen Verlust ihres Absorptionsvermögens zu verhindern.
3) [Ton und Schluff] ist die mineralische Fraktion des Sediments mit einer Partikelgröße von < 50 µm.
4) Aktuelle Studien haben gezeigt, dass eine Lagerung bei 4°C zu einer Verminderung des organischen Kohlenstoffgehalts des Sediments führen kann, was unter Umständen einen Rückgang der mikrobiellen Aktivität zur Folge hat (34).
5) Ein Test mit einer zweiten Konzentrationsstufe kann bei Chemikalien von Nutzen sein, die auf verschiedenen Eintragspfaden in Oberflächengewässer gelangen und somit signifikant unterschiedliche Konzentrationen aufweisen, sofern die niedrigere Konzentration mit hinreichender Genauigkeit analytisch bestimmt werden kann.
6) Falls es ohne weiteres zu einer schnellen Reoxidation anaerober Transformationsprodukte kommen kann, sollten während der Probenahme und Analyse anaerobe Bedingungen sichergestellt werden.
 |
weiter . |  |
(Stand: 04.08.2022)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: ab 105.- € netto
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion