

 |
zurück |  |
| Bestimmung der Ökotoxizität C.23. Aerore und Anaerobe Transformation im Boden Stand RL 2004/73/EG |
Anhang V zur RL 67/548/EWG |
C.23. 1. Methode
Diese Testmethode entspricht der Prüfrichtlinie OECD TG 307 (2002)
C.23. 1.1 Einleitung
Die Testmethode basiert auf bestehenden Richtlinien (1)(2)(3)(4)(5)(6)(7)(8)(9). Das in dieser Testmethode beschriebene Verfahren soll eine Evaluierung der aeroben und anaeroben Transformationsprozesse von Chemikalien im Boden ermöglichen. Die Tests sind so konzipiert, dass, (i) die Transformationsrate der Testsubstanz und (ii) die Art der Transformationsprodukte sowie Bildungs- und Abbauraten bestimmt werden. So können die Konzentrationen von Chemikalien, bzw. deren Transformationsprodukten, denen Pflanzen und Bodenorganismen ausgesetzt sein können, errechnet werden. Solche Untersuchungen sind für Chemikalien erforderlich, die direkt auf den Boden ausgebracht werden, bzw. bei denen die Möglichkeit besteht, dass sie in den terrestrischen Bereich gelangen.. Die Ergebnisse solcher Laboruntersuchungen können auch dazu genutzt werden, Probenahme- und Analysevorschriften für gleichgelagerte Feldstudien zu entwickeln.
Im Allgemeinen sind aerobe und anaerobe Untersuchungen mit einer Bodenart für die Untersuchung der Transformationspfade im Bodenausreichend (8)(10)(11). Die Transformationsraten sollten mit mindestens drei zusätzlichen Böden bestimmt werden (8)(10).
Auf einem OECD-Workshop zur Boden-/Sedimentauswahl, der 1995 im italienischen Belgirate stattfand (10), wurden insbesondere die Anzahl und Arten der in diesem Test zu verwendenden Böden vereinbart. Die im Test verwendeten Böden sollten repräsentativ für die im Freiland bei Chemikalieneinsatz bzw. - -eintrag exponierten Böden sein. So sollten etwa Chemikalien, die möglicherweise in subtropischem bis tropischem Klima freigesetzt werden, mit Ferrasolen oder Nitosolen (FAO-System) getestet werden. Des Weiteren gab der Workshop basierend auf der ISO-Anleitung (15) Empfehlungen zur Entnahme, Handhabung und Lagerung von Bodenproben. Die Verwendung von Reisböden ist in dieser Methode ebenfalls berücksichtigt.
C.23. 1.2 Definitionen
Testsubstanz: jede Substanz, ob Ausgangssubstanz oder relevante Transformationsprodukte.
Transformationsprodukte: alle Substanzen, die durch biotische oder abiotische Transformationsreaktionen der Testsubstanz entstehen, einschließlich CO2 und Reaktionsprodukte in gebundenen Rückständen.
Gebundene Rückstände: "Gebundene Rückstände" sind Verbindungen in Boden, Pflanzen oder Tieren, die nach einer Extraktion in der Matrix in Form der Ausgangssubstanz oder deren Metaboliten/Transformationsprodukte(n) verbleiben. Die Extraktionsmethode darf die Verbindungen selbst oder die Matrixstruktur nicht wesentlich verändern. Durch matrixverändernde Extraktionsmethoden und hochentwickelte Analysenverfahren kann die Art der Bindung zum Teil geklärt werden. Bislang werden z.B. kovalente Ionen- und Sorptionsbindungen sowie Einschlüsse auf diese Weise nachgewiesen. In aller Regel bedeutet die Bildung von gebundenen Rückständen eine deutliche Verminderung der Bioverfügbarkeit (12) (modifiziert nach IUPAC 1984 (13)].
Aerobe Transformation: in Gegenwart von molekularem Sauerstoff ablaufende Reaktionen (14).
Anaerobe Transformation: unter Ausschluss von molekularem Sauerstoff ablaufende Reaktionen (14).
Boden: ein Gemisch mineralischer und organisch-chemischer Bestandteile, wobei letztere Verbindungen mit hohem Kohlenstoff- und Stickstoffgehalt sowie einem hohen Molekulargewicht enthalten und mit kleinen (zumeist Mikro-)Organismen belebt sind. Boden kann in zwei Zustandsformen bearbeitet werden:
Mineralisation: vollständiger Abbau einer organischen Verbindung zu CO2 und H2O unter aeroben Bedingungen und zu CH4, CO2 und H2O unter anaeroben Bedingungen. Im Zusammenhang mit dieser Testmethode, bei der eine14C-markierte Verbindung verwendet wird, bedeutet Mineralisation einen extensiven Abbau, wobei ein markiertes Kohlenstoffatom unter Freisetzung der entsprechenden Menge14CO2 oxidiert wird (14).
Halbwertszeit t05: die für die 50%ige Transformation einer Testsubstanz ermittelte Zeit, wenn die Transformation mittels Kinetik erster Ordnung beschrieben werden kann; sie ist konzentrationsunabhängig
Abbauzeit DT50: Zeitspanne, in der sich die Konzentration der Testsubstanz um 50% reduziert hat; sie unterscheidet sich von der Halbwertszeit t0,5, wenn die Transformation nicht nach der Kinetik erster Ordnung erfolgt.
Abbauzeit DT75: Zeitspanne, in der sich die Testsubstanzkonzentration um 75% reduziert hat.
Abbauzeit DT90: Zeitspanne, in der sich die Testsubstanzkonzentration um 90% reduziert hat.
C.23. 1.3 Referenzsubstanzen
Referenzsubstanzen sollten zur Charakterisierung und/oder zur Identifizierung von Transformationsprodukten mittels spektroskopischer und chromatographischer Verfahren verwendet werden.
C.23. 1.4 Anwendbarkeit des Tests
Die Methode ist auf sämtliche chemischen Substanzen (nichtmarkiert oder radioaktiv markiert) anwendbar, für die ein Analysenverfahren mit hinreichender Genauigkeit und Empfindlichkeit zur Verfügung steht. Sie ist anwendbar auf schwach flüchtige, nichtflüchtige, wasserlösliche oder wasserunlösliche Verbindungen. Bei Chemikalien, die aus Böden hochflüchtig sind (z.B. Begasungsmittel oder organische Lösungsmittel) und somit unter den Testbedingungen dieses Tests nicht im Boden gehalten werden können, sollte der Test nicht angewendet werden.
C.23. 1.5 Informationen zur Testsubstanz
Zur Messung der Transformationsrate kann nichtmarkierte oder markierte Testsubstanz verwendet werden. Markiertes Material ist zur Untersuchung des Umwandlungsweges und zur Aufstellung einer Massenbilanz notwendig. Empfohlen wird die14C-Markierung, doch auch der Einsatz anderer Isotope wie13C,15N,3H oder32P kann sinnvoll sein. Die Markierung sollte möglichst im stabilsten Teil, bzw. in den stabilsten Teilen des Moleküls positioniert sein 1. Der Reinheitsgrad der Testsubstanz sollte mindestens 95% betragen.
Vor der Durchführung eines Tests zur aeroben und anaeroben Transformation im Boden sollten folgende Informationen zur Testsubstanz vorliegen:
Außerdem können Angaben zur Toxizität der Testsubstanz gegenüber Bodenmikroorganismen sinnvoll sein [Testmethoden C.21 und C.22] (16).
Es sollten Analysenmethoden (einschließlich Extraktions und Reinigungsverfahren) zur Identifizierung und Quantifizierung der Testsubstanz sowie ihrer Transformationsprodukte verfügbar sein.
C.23. 1.6 Prinzip der Testmethode
Den Bodenproben wird die Testsubstanz zugefügt und die Proben werden im Dunkeln in einem Biometer-Gefäß oder einem Durchflusssystem unter kontrollierten Laborbedingungen (bei konstanter Temperatur und Bodenfeuchtigkeit) inkubiert. Nach entsprechenden Zeitintervallen werden die Bodenproben extrahiert und auf die Ausgangssubstanz und Transformationsprodukte analysiert. Außerdem werden flüchtige Produkte mit Hilfe geeigneter Absorptionsvorrichtungen für die Analyse gesammelt. Mittels14C-markiertem Material können die verschiedenen Mineralisationsraten von Testsubstanzen durch Auffangen von entstandenem14CO2 gemessen werden und es kann eine Massenbilanz, einschließlich der Bildung von bodengebundenen Rückständen, aufgestellt werden.
C.23. 1.7 Qualitätskriterien
C.23. 1.7.1 Wiederfindungsraten
Die Extraktion und Analyse von mindestens zwei parallel angesetzten Bodenproben unmittelbar nach Zugabe der Testsubstanz, geben einen ersten Hinweis auf die Wiederholbarkeit der Analysenmethode und die gleichmäßige Verteilung der Testsubstanz bei der Applikation. Die Wiederfindungsraten für spätere Testphasen ergeben sich aus den jeweiligen Massenbilanzen. Die Wiederfindungsraten sollten im Bereich von 90-110% für markierte Chemikalien (8) und von 70-110% für nichtmarkierte Chemikalien (3) liegen.
C.23. 1.7.2 Wiederholbarkeit und Empfindlichkeit der Analysenmethode
Die Wiederholbarkeit der Analysenmethode (ausgenommen die Effizienz der Extraktion im Anfangsstadium) zur Quantifizierung der Testsubstanz und der Transformationsprodukte kann durch eine parallele Analyse desselben Extrakts einer Bodenprobe, die hinreichend lange zur Bildung von Transformationsprodukten inkubiert wurde, überprüft werden.
Die Nachweisgrenze ("limit of detection; LOD") der Analysenmethode für die Testsubstanz und für die Transformationsprodukte sollte mindestens 0,01 mg kg Boden (als Testsubstanz) oder - falls dieser Wert niedriger ist - 1% der Applikationskonzentration betragen. Die Quantifizierungsgrenze ("limit of quantification; LOQ") sollte ebenfalls spezifiziert werden.
C.23. 1.7.3 Genauigkeit der Transformationsdaten
Geeignete Informationen über die Zuverlässigkeit der Transformationskurve lassen sich mittels Regressionsanalyse aus den Testsubstanzkonzentrationen in Abhängigkeit von der Zeit gewinnen, die auch die Berechnung des Vertrauensbereichs für Halbwertszeiten (im Falle einer Kinetik pseudo-erster Ordnung) bzw. DT50-Werte und ggf. für DT75- und DT90-Werte ermöglicht.
C.23. 1.8 Beschreibung der Testmethode
C.23. 1.8.1 Geräte und chemische Reagenzien
Inkubationssysteme bestehen aus statischen geschlossenen Systemen oder geeigneten Durchflusssystemen (7)(17). Beispiele für eine geeignete Durchfluss-Bodeninkubationssapparatur und ein Biometer-Gefäß sind in den Abb. 1 bzw. 2 dargestellt. Beide Arten von Inkubationssystemen haben Vorteile und Einschränkungen (7)(17).
Erforderlich ist die Standardlaborausstattung, insbesondere folgendes:
Einzusetzende chemische Reagenzien sind z.B.:
C.23. 1.8.2 Applikation der Testsubstanz
Für die Zugabe zum Boden und die Verteilung darin, kann die Testsubstanz in Wasser (entionisiert oder destilliert) oder - falls notwendig - in möglichst geringen Mengen Aceton oder anderen organischen Lösungsmitteln (6) gelöst werden, in denen die Testsubstanz hinreichend löslich und stabil ist. Die gewählte Lösungsmittelmengesollte jedoch keinen signifikanten Einfluss auf die Aktivität der Bodenmikroorganismen haben (siehe Abschnitte 1.5 und 1.9.2-1.9.3). Die Verwendung von Lösungsmitteln, die die Aktivität der Bodenmikroorganismen hemmen, wie etwa Chloroform, Dichlormethan oder andere halogenierte Lösungsmittel, ist zu vermeiden.
Die Testsubstanz kann auch als Feststoff zugegeben werden, z.B. in Quarzsand (6) eingemischt oder in einer kleinen Teilprobe des Testbodens, die zuvor luftgetrocknet und sterilisiert wurde. Wird die Testsubstanz unter Verwendung eines Lösungsmittels zugegeben, muss das Lösungsmittel verdampfen können, bevor die Teilprobe der ursprünglichen nichtsterilen Bodenprobe zugesetzt wird.
Bei gebräuchlichen Chemikalien, deren Eintrag in den Boden hauptsächlich über Klärschlamm/Anwendung in der Landwirtschaft erfolgt, sollte die Testsubstanz zuerst dem Schlamm zugesetzt werden, der dann in die Bodenprobe eingebracht wird (siehe Abschnitte 1.9.2 und 1.9.3).
Die Verwendung von formulierten Handelsprodukten wird nicht routinemäßig empfohlen. Sie kann jedoch z.B. bei schlecht löslichen Testsubstanzen eine geeignete Alternative sein.
C.23. 1.8.3 Böden
C.23. 1.8.3.1 Bodenauswahl
Zur Bestimmung der Transformationswege kann ein repräsentativer Boden verwendet werden; empfohlen werden sandiger Lehm oder schluffiger Lehm oder Lehm oder lehmiger Sand [gemäß FAO und USDA-Klassifikation(18)] mit einem pH-Wert von 5,5-8,0, einem organischen Kohlenstoffgehalt von 0,5-2,5 % und einer mikrobiellen Biomasse von mindestens 1 % des gesamten organischen Kohlenstoffs (10).
Zur Untersuchung der Transformationssraten sollten mindestens drei zusätzliche Böden verwendet werden, die einen Bereich allerrelevanter Böden repräsentieren. Die Böden sollten sich hinsichtlich des organischen Kohlenstoffgehalts, des pH-Werts, des Tongehalts und der mikrobiellen Biomasse voneinander unterscheiden (10).
Alle Böden sollten mindestens hinsichtlich folgender Eigenschaften charakterisiert werden: Textur (% Sand, % Schluff, % Ton) [gemäß FAO und der USDA-Klassifikation (18)], pH-Wert, Kationenaustauschkapazität, organischer Kohlenstoffgehalt, Bodendichte, Wasserrückhalteeigenschaft 2 und mikrobielle Biomasse (nur für aerobe Untersuchungen). Zusätzliche Informationen über Bodeneigenschaften können für die Interpretation der Ergebnisse von Nutzen sein. Zur Bestimmung der Bodeneigenschaften können die in den Literaturangaben (19)(20)(21)(22)(23) empfohlenen Methoden herangezogen werden. Die mikrobielle Biomasse sollte mit Hilfe der Substrat-induzierten Respirationsmethode (SIR) (25)(26) oder alternativer Verfahren (20) bestimmt werden.
C.23. 1.8.3.2 Probenahme, Handhabung und Lagerung von Böden
Es sind ausführliche Informationen über die Geschichte des Feldstandorts erforderlich, von dem der Testboden entnommen wird. Die Angaben betreffen unter anderem die genaue Lage, den Bewuchs, Behandlungen mit Chemikalien sowie mit organischen und anorganischen Düngemitteln, Zusätze biologischer Materialien oder anderer Verunreinigungen. Böden, die in den vorhergehenden vier Jahren mit der Testsubstanz oder ihren Struktur-Analoga behandelt worden sind, sollten nicht für die Transformationsuntersuchungen verwendet werden (10)(15).
Der Boden sollte feldfrisch entnommen werden (aus dem A-Horizont oder bis zu einer Tiefe von maximal 20 cm) und einen Bodenwassergehalt aufweisen, der das Sieben ermöglicht. Bei Böden, die nicht von Reisfeldern stammen, sollte die Probenahme während oder unmittelbar nach längeren (> 30 Tage) Dürre-, Frost- oder Überschwemmungsperioden vermieden werden (14). Die Proben sollten so transportiert werden, dass der Bodenwassergehalt möglichst unverändert bleibt, und sie sollten unter freiem Luftzutritt dunkel aufbewahrt werden. Im Allgemeinen ist ein locker verschlossener Polyethylenbeutel geeignet.
Der Boden sollte so schnell wie möglich nach der Probenahme bearbeitet werden. Vegetationsreste, größere Bodentiere und Steine sollten entfernt werden, bevor der Boden durch ein Sieb mit 2 mm Maschenweite gegeben wird, um kleine Steine, Bodentiere und Pflanzenteile zu entfernen. Ein übermäßiges Austrocknen und Zerkleinern des Bodens vor dem Sieben ist zu vermeiden (15).
Wenn die Probenahme auf dem Feld im Winter schwierig ist (Boden gefroren oder schneebedeckt), kann auf Boden zurückgegriffen werden, der im Gewächshaus unter einer Pflanzenabdeckung (Gras oder Gras-Klee-Mischung) gelagert wurde. Untersuchungen mit feldfrischen Böden werden in jedem Fall bevorzugt, doch wenn der entnommene und bearbeitete Boden vor Beginn der Untersuchungen gelagert werden muss, dann unter angemessenen Bedingungen und nur für eine begrenzte Dauer (höchstens drei Monate bei 4 ± 2 °C), um die mikrobielle Aktivität zu erhalten 3. Ausführliche Anweisungen zur Probenahme, Handhabung und Lagerung von Böden für Untersuchungen der Biotransformation sind zu finden in (8)(10)(15)(26)(27).
Bevor der bearbeitete Boden für diesen Test verwendet wird, sollte er vorinkubiert werden, um das Keimen und Entfernen von Samen zu ermöglichen, und im Anschluss an den Wechsel von den Probenahme- oder Lagerungsbedingungen zu den Inkubationsbedingungen wieder ein Gleichgewicht des Mikrobenstoffwechsels herzustellen. Im Allgemeinen ist eine Vorinkubationsdauer von 2 bis 28 Tagen unter annähernder Einhaltung der Temperatur- und Feuchtigkeitsbedingungen des eigentlichen Tests ausreichend (15). Lagerung und Vorinkubation sollten zusammengenommen nicht länger als drei Monate dauern.
C.23. 1.9 Durchführung des Tests
C.23. 1.9.1 Testbedingungen
C.23. 1.9.1.1 Testtemperatur
Während der gesamten Testdauer sollten die Böden im Dunkeln bei einer konstanten Temperatur inkubiert werden, die für die klimatischen Bedingungen, unter denen der Einsatz bzw. die Freisetzung erfolgt, repräsentativ ist. Für alle Testsubstanzen, die in gemäßigten Klimazonen in den Boden gelangen können, wird eine Temperatur von 20 ± 2 °C empfohlen. Die Temperatur sollte überwacht werden.
Bei Chemikalien, die in kälteren Klimazonen angewandt bzw. eingetragen werden (z.B. in nördlichen Ländern oder während des Herbstes/Winters), sollten zusätzlich Bodenproben bei einer niedrigeren Temperatur inkubiert werden (z.B. 10 ± 2 °C).
C.23. 1.9.1.2 Feuchtegehalt
Bei Transformationstests unter aeroben Bedingungen sollte der Feuchtegehalt 4 des Bodens auf einen pF-Wert von 2,0 bis 2,5 eingestellt und bei diesem Wert gehalten werden (3). Der Feuchtegehalt des Bodens wird als Masse Wasser pro Masse Boden (Trockengewicht) ausgedrückt und sollte regelmäßig kontrolliert werden (z.B. alle zwei Wochen), indem die Inkubationsgefäße gewogen und Wasserverluste ersetzt werden (vorzugsweise mit sterilfiltriertem Leitungswasser). Es ist darauf zu achten, dass während der Zugabe von Feuchtigkeit Verluste von Testsubstanz und/oder Transformationsprodukten durch Verflüchtigung und/oder ggf. photochemischen Abbau möglichst verhindert oder minimiert werden .
Für Transformationstests unter anaeroben und Reisanbaubedingungen wird der Boden durch Überflutung mit Wasser gesättigt.
C.23. 1.9.1.3 Aerobe Inkubationsbedingungen
Bei Durchflusssystemen werden aerobe Bedingungen durch diskontinuierliches Spülen oder kontinuierliches Belüften mit befeuchteter Luft aufrechterhalten. In Biometer-Gefäßen wird der ständige Austausch von Luft durch Diffusion ermöglicht.
C.23. 1.9.1.4 Sterile aerobe Bedingungen
Um Informationen über die Relevanz der abiotischen Transformation einer Testsubstanz zu gewinnen, können Bodenproben sterilisiert (zu Sterilisationsverfahren vgl. (16) und (29)), mit einer sterilen Testsubstanz behandelt (z.B. Zugabe der Lösung durch ein Sterilfilter) und mit steriler befeuchteter Luft, wie in Abschnitt 1.9.1.3 beschrieben, belüftet werden. Bei Reisböden sollten Boden und Wasser sterilisiert und die Inkubation wie in Abschnitt 1.9.1.6 beschrieben durchgeführt werden.
C.23. 1.9.1.5 Anaerobe Inkubationsbedingungen
Zum Erreichen und Aufrechterhalten anaerober Bedingungen wird der mit der Testsubstanz behandelte und unter aeroben Bedingungen für 30 Tage bzw. eine Halbwertszeit oder DT50 (je nachdem, was kürzer ist) inkubierte Boden mit Wasser überflutet (Wassersäule 1-3 cm), und das Inkubationssystem wird mit einem inerten Gas (z.B. Stickstoff oder Argon) gespült 5. Das Testsystem muss Messungen z.B. des pH-Werts, der Sauerstottkonzentration und des Redoxpotenzials ermöglichen und Absorptionsfallen für flüchtige Reaktionsprodukte beinhalten. Das Biometersystem muss geschlossen sein, um den Zutritt von Luft durch Diffusion zu vermeiden.
C.23. 1.9.1.6 Inkubation unter Reisfeldbedingungen
Zur Untersuchung der Transformation in Reisfeldböden wird der Boden mit einer Wassersäule von etwa l-5 cm Höhe überflutet und die Testsubstanz in die Wasserphase appliziert (9). Es wird eine Bodentiefe von mindestens 5 cm empfohlen. Das System wird mit Luft wie unter aeroben Bedingungen belüftet. Der pH-Wert, die Sauerstoftkonzentration und das Redoxpotenzial der Wassersäule sollten überwacht und aufgezeichnet werden. Vor der Aufnahme der Transformationsuntersuchungen ist eine Vorinkubationsdauer von mindestens zwei Wochen erforderlich (siehe Abschnitt 1.8.3.2).
C.23. 1.9.1.7 Testdauer
Die Untersuchungen zu Geschwindigkeit und Transformationsverlauf sollten nicht länger als 120 Tage dauern 6 (3)(6)(8), da danach in einem künstlichen Laborsystem, isoliert von natürlichen Revitalisierungsprozessen, eine Abnahme der mikrobiellen Aktivität im Boden mit der Zeit zu erwarten wäre. Falls es für die Charakterisierung des Testsubstanzabbaus sowie der Bildung und des Abbaus der Transformationsprodukte erforderlich ist , können die Untersuchungen über längere Zeiträume fortgesetzt werden (z.B. 6 oder 12 Monate) (8). Längere Inkubationszeiten sollten im Testbericht begründet und durch Biomassemessungen im Verlaufe und am Ende dieser Zeiträume begleitet werden .
C.23. 1.9.2 Durchführung des Tests
In jedes Inkubationsgefäß werden etwa 50 bis 200 g Boden (Bezugsbasis Trockengewicht) gegeben (siehe Abbildungen 1 und 2 in Anhang 3), und der Boden wird nach einem der in Abschnitt 1.8.2 beschriebenen Verfahren mit der Testsubstanz behandelt. Werden organische Lösungsmittel für die Applikation der Testsubstanz verwendet, sollten sie durch Verdampfen aus dem Boden entfernt werden. Anschließend wird der Boden mit einem Spatel und/oder durch Schütteln des Gefäßes gründlich durchmischt. Wird die Untersuchung unter Reisfeldbedingungen durchgeführt, sollten Boden und Wasser nach Applikation der Testsubstanz gründlich gemischt werden. Zur Überprüfung der gleichmäßigen Verteilung sollten kleine Allquoten (z.B. 1 g) des behandelten Bodens auf die Testsubstanzgehalte analysiert werden. Angaben zu einem alternativen Verfahren siehe unten.
Die Testkonzentration sollte der höchsten Anwendungsrate eines Pflanzenschutzmittels laut den Empfehlungen in der Gebrauchsanleitung und einer gleichmäßigen Einarbeitung in eine geeignete Tiefe im Feld (z.B. bis zu einer Tiefe von 10 cm 7 in den Boden) entsprechen. So beträgt z.B. bei Chemikalien, die auf die Blätter oder den Boden ohne Einarbeitung ausgebracht werden, die geeignete Tiefe für die Berechnung der in jeden Gefäß zu gebenden Chemikalie 2,5 cm. Bei in den Boden eingearbeiteten Chemikalien ist die geeignete Tiefe die in der Gebrauchsanleitung genannte Einarbeitungstiefe. Für Chemikalien im allgemeinen sollte die Applikationsrate basierend auf dem Haupteintragspfad gewählt werden. Wenn z.B. der Eintrag in den Boden hauptsächlich über Klärschlamm erfolgt, sollte die Chemikalie im Schlamm so dosiert werden, dass ihre Konzentration im Verhältnis zu der erwarteten Schlammkonzentration steht, und der dem Boden zugegebene Schlamm sollte im Verhältnis zum üblichen Schlammeintrag in landwirtschaftlich genutzte Böden stehen. Ist diese Konzentration nicht hoch genug, um die wichtigsten Transformationsprodukte nachzuweisen, kann eine Inkubation gesonderter Bodenproben mit höheren Mengen hilfreich sein, doch sollten zu hohe Mengen, die die Funktionen der Bodenmikroorganismen beeinflussen, vermieden werden (siehe Abschnitte 1.5 und 1.8.2).
Alternativ kann eine größere Charge (d. h. 1 bis 2 kg) Boden mit der Testsubstanz behandelt werden; dieser Ansatz wird in einem geeigneten Mischgerät sorgfältig gemischt und anschließend in kleinen Teilen von 50 bis 200 g in die Inkubationsgefäße gegeben (z.B. unter Verwendung von Probenteilern). Zur Überprüfung der gleichmäßigen Verteilung sollten kleine Aliquoten (z.B. 1 g) des behandelten Bodens auf die Testsubstanzgehalte analysiert werden. Ein solches Verfahren wird bevorzugt, da es eine gleichmäßigere Verteilung der Testsubstanz im Boden ermöglicht.
Zusätzlich zu den mit Testsubstanz behandelten Proben werden unbehandelte Bodenproben unter den gleichen Bedingungen (aerob) inkubiert . Diese Proben werden zur Messung der Biomasse im Verlaufe und am Ende der Untersuchungen herangezogen.
Wird die Testsubstanz mit Hilfe eines organischen Lösungsmittels/ mehrerer organischer Lösungsmittel gelöst auf den Boden aufgebracht, werden mit der gleichen Menge des Lösungsmittels (der Lösungsmittel) behandelte Bodenproben unter den gleichen Bedingungen (aerob) inkubiert, wie die mit der Testsubstanz behandelten Proben. Diese Proben werden zur Biomassemessung zu Testbeginn, während des Tests und zu Testende herangezogen, um die Wirkungen des Lösungsmittels/der Lösungsmittel auf die mikrobielle Biomasse zu prüfen.
Die den behandelten Boden enthaltenden Gefäße werden entweder an das in Abbildung 1 dargestellte Durchflusssystem angeschlossen oder mit der in Abbildung 2 gezeigten Absorptionskolonne verschlossen (siehe Anhang 3).
C.23. 1.9.3 Probenahme und Messung
Parallel-Inkubationsgefiiße werden in entsprechenden Zeitintervallen entnommen und die Bodenproben mit geeigneten Lösungsmitteln unterschiedlicher Polarität extrahiert und auf die Testsubstanz und/oder Transformationsprodukte analysiert. Bei einer gut konzipierten Untersuchung ist eine ausreichende Zahl von Gefäß vorgesehen, so dass zu jedem Probenahmetermin zwei Gefäße entnommen werden. Zudem werden in verschiedenen Zeitintervallen (7-Tage-Intervalle während des ersten Monats und 17-Tage-Intervalle nach einem Monat) Absorptionslösungen bzw. feste Absorptionsmittel im Verlaufe und am Ende der Inkubation jeder Bodenprobe entfernt und auf flüchtige Produkte analysiert. Abgesehen von einer unmittelbar nach der Applikation (0-Tage-Probe) genommenen Bodenprobe sollten mindestens 5 zusätzliche Probenahmetermine vorgesehen sein. Die Zeitintervalle sollten derart ausgewählt werden, dass ein Abbauschema für die Testsubstanz und ein Bildungs- und Abbauschema für die Transformationsprodukte erstellt werden können (z.B. 0, 1, 3, 7 Tage; 2, 3 Wochen; 1, 2, 3 Monate usw.).
Wird eine14C-markierte Testsubstanz verwendet, wird die nichtextrahierbare Radioaktivität durch Verbrennung quantifiziert, und für jedes Probenahmeintervall wird eine Massenbilanz berechnet.
Im Falle einer anaeroben Inkubation sowie einer Inkubation unter Reisfeldbedingungen werden die Boden- und Wasserphasen gemeinsam auf die Testsubstanz und Transformationsprodukte analysiert oder vor der Extraktion und Analyse durch Filtrieren oder Zentrifugieren abgetrennt.
C.23. 1.9.4 Fakultative Test
Aerobe, nichtsterile Untersuchungen bei zusätzlichen Temperaturen und Bodenfeuchten können sinnvoll sein, wenn es darum geht, den Einfluss von Temperatur und Bodenfeuchte auf die Transformationsgeschwindigkeit einer Testsubstanz und/oder ihrer Transformationsprodukte im Boden abzuschätzen.
Eine weitere Charakterisierung von nichtextrahierbarer Radioaktivität kann z.B. mittels überkritischer Flüssigextraktion versucht werden.
C.23. 2 Daten
C.23. 2.1 Aufbereitung der Ergebnisse
Die Konzentrationen der Testsubstanz, Transformationsprodukte, flüchtigen Substanzen (nur in %) und nichtextrahierbaren Substanzen sollten in % der applizierten Ausgangskonzentration und ggf. in mg×kg-1 Boden (Bezugsbasis Trockengewicht) für jedes Probenahmeintervall angegeben werden. Eine Massenbilanz in Prozent, bezogen auf die Ausgangskonzentration sollte für jedes Probenahmeintervall erstellt werden. Eine graphische Darstellung der Testsubstanzkonzentrationen in Abhängigkeit von der Zeit wird eine Einschätzung der Transformationshalbwertszeit bzw. der DT50 ermöglichen. Die Haupttransformationsprodukte sollten identifiziert und ihre Konzentrationen ebenfalls über der Zeit aufgetragen werden, um die jeweilige Geschwindigkeit ihrer Bildung und ihres Abbaus aufzuzeigen. Ein Haupttransformationsprodukt ist jedes Reaktionsprodukt, das zu irgendeinem Zeitpunkt des Tests mit einer Konzentration e 10 % der Applikationskonzentration vorliegt.
Die aufgefangenen flüchtigen Produkte geben Hinweise auf das Flüchtigkeitspotenzial einer Testsubstanz und ihrer Transformationsprodukte im Boden.
Eine genauere Bestimmung der Halbwertszeiten bzw. DT50-Werte und ggf. DT75- und DT90-Werte sollte durch die Anwendung geeigneter Kinetikmodellberechnungen möglich sein. Die Halbwertszeiten und DT50-Werte sollten zusammen mit der Beschreibung des verwendeten Modells, der Kinetikordnung und des Determinationskoeffizienten (r2) angegeben werden. Bevorzugt wird die Kinetik erster Ordnung, sofern nicht r2 < 1,7. Ggf. sollten die Berechnungen auch bei den Haupttransformationsprodukten angewendet werden. Beispiele für zweckmäßige Modelle sind in den Literaturangaben 31 bis 35 beschrieben.
Wurden Untersuchungen bei verschiedenen Temperaturen durchgeführt,sollten die Transformationsraten in Abhängigkeit von der Temperatur, innerhalb des eingesetzten experimentellen Temperaturbereichs dargestellt werden, und zwar unter Verwendung der Arrhenius-Gleichung, in der Form:
| B | |
| k=A.· cB/T oder Ink = lnA- | __, |
| T |
wobei In a und B Regressionskonstanten aus dem Achsenabschnitt bzw. der Steigung einer Ausgleichsgeraden sind, die durch lineare Regression von In k gegen l/T erzeugt wird. k ist die Geschwindigkeitskonstante bei der Temperatur T und T ist die Temperatur in Kelvin ist. Es ist auf den begrenzten Temperaturbereich zu achten, in dem die Arrhenius-Gleichung gültig ist, wenn die Transformation auf mikrobieller Aktivität beruht.
C.23. 2.2 Evaluierung und Interpretation der Ergebnisse
Obwohl die Untersuchungen in einem künstlichen Laborsystem stattfinden, lassen die Ergebnisse doch eine Einschätzung der Transformationsrate der Testsubstanz und auch der Bildungs- und Abbaurate der Transformationsprodukte unter Feldbedingungen zu (36)(37).
Eine Untersuchung der Transformationswege einer Testsubstanz vermittelt Erkenntnisse über die Art und Weise wie die Substanz im Boden in ihrer Struktur durch chemische und mikrobielle Reaktion verändert wird.
C.23. 3 Abschlussbericht
Testbericht
Der Testbericht muss folgende Angaben enthalten:
Testsubstanz:
Referenzsubstanzen:
Testböden:
Testbedingungen:
Applikationsmenge der Testsubstanz;
Ergebnisse:
C.23. 4 Literaturangaben
(1) US- Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
(2) Agriculture Canada (1987). Environmental Chemistry and Fate. Guidelines for registration of pesticides in Canada.
(3) Europäische Union (EU) (1995). Richtlinie 95/36/EG der Kommission vom 14. Juli 1995 zur Änderung der Richtlinie 91/414/EWG über das Inverkehrbringen von Pflanzenschutzmitteln. Anhang II, Teil A, und Anhang III, Teil A: Verbleib und Verhalten in der Umwelt.
(4) Dutch Commission for Registration of Pesticides (1995). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
(5) BBa (1986). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-1. Verbleib von Pflanzenschutzmitteln im Boden - Abbau, Umwandlung und Metabolismus.
(6) ISO/DIS 11266-1 (1994). Soil Quality -Guidance on laboratory tests for biodegradation of organic chemicals in soil - Part 1 : Aerobic conditions.
(7) ISO 14239 (1997). Bodenbeschaffenheit - Laboratoriumsinkubationssysteme zur Bestimmung der Mineralisierung von organischen Chemikalien im Boden unter aeroben Bedingungen.
(8) SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
(9) MAFF - Japan 2000 - Draft Guidelines for transformation studier of pesticides in soll - Aerobic metabolism study in soil under paddy field conditions (flooded).
(10) OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italien, 18.-20. Januar 1995.
(11) Guth, J.A. (1980). The study of transformations. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, 123-157.
(12) DFG: Pesticide Bound Residues in Soil. Wiley - VCH (1998).
(13) T.R. Roberts: Non-extractable pesticide residue in soils and plants. Pure Appl. Chem. 56, 945-956 (IUPAC 1984)
(14) OECD Test Guideline 304 A: Inherent Biodegradability in Soll (angenommen am 12. Mai 1981)
(15) ISO 10381-6 (1993). Bodenbeschaffenheit - Probenahme - Teil 6: Anleitung zur Probenahme, Behandlung und Lagerung von Boden für die Bestimmung aerober mikrobieller Prozesse unter Laborbedingungen.
(16) Anhang V zur Richtlinie 67/548/EWG
(17) Guth, J.A. (1981). Experimental approaches to studying the fate of pesticides in soll. In Progress in Pesticide Biochemistry. D.H. Hutson, T.R. Roberts, Eds. J. Wiley & Sons. Vol 1, 85-114.
(18) Soll Texture Classification (US and FAO Systems): Weed Science, 33, Suppl. 1 (1985) und Soll Sci. Soc. Amer. Proc. 26:305 (1962).
(19) Methods of Soil Analysis (1986). Part 1, Physical and Mineralogical Methods. A. Klute, Ed.) Agronomy Series No 9, 2nd Edition.
(20) Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties. A.L. Page, R.H. Miller and D.R. Kelney, Eds. Agronomy Series No 9, 2nd Edition.
(21) ISO Standard Compendium Environment (1994). Soll Quality - General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition.
(22) Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main.
(23) Scheffer, F., Schachtschabel, P. (1975). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
(24) Anderson, J.P.E., Domsch, K.H. (1978) a physiological method for the quantitative measurement of microbial biomass in soils. Soil Biol. Blochern. 10, 215-221.
(25) ISO 14240-1 und 2 (1997). Bodenbeschaffenheit - Bestimmung der mikrobiellen Biomasse von Böden - Teil 1: Substratinduziertes Respirationsverfahren. Teil 2: Fumigations-Extraktionsverfahren.
(26) Anderson, J.P.E. (1987). Handling and storage of soils for pesticide experiments. In Pesticide Effects on Soil Microflora. L. Somerville, M.P. Greaves, Eds. Taylor & Francis, 45-60.
(27) Kato, Yasuhiro. (1998). Mechanism of pesticide transformation in the environment: Aerobic and biotransformation of pesticides in aqueous environment. Proceedings of the 16'1' Symposium on Environmental Science of Pesticide, 105-120.
(28) Keuken O., Anderson J.P.E. (1996). Influence of storage on biochemical processes in soll. In Pesticides, Soll Microbiology and Soll Quality, 59-63 (SETAC-Europe).
(29) Stenberg B., Johansson M., Pell M., Sjödahl-Svensson K., Stenström J., Torstensson L. (1996). Effect of freeze and cold storage of soll on microbial activities and biomass. In Pesticides, Soll Microbiology and Soll Quality, 68-69 (SETAC-Europe).
(30) Gennari, M., Negre, M., Ambrosoli, R. (1987). Effects of ethylene oxide on soll microbial content and some chemical characteristics. Plant and Soil 102, 197-200.
(31) Anderson, J.P.E. (1975). Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, 141-146.
(32) Hamaker, J.W. (1976). The application of mathematical modelling to the soll persistence and accumulation of pesticides. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides, 181-199.
(33) Goring, C.A.I., Laskowski, D.A., Hamaker, J.W., Meikle, R.W. (1975). Principles of pesticide degradation in soil. In "Environmental Dynamics of Pesticides". R. Haque and V.H. Freed, Eds., 135-172.
(34) Timme, G., Frehse, H., Laska, V. (1986). Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. II. Pflanzenschutz - Nachrichten Bayer 39, 188-204.
(35) Timme, G., Frehse, H. (1980). Statistical interpretation and graphic representation of the degradational behaviour of pesticide residues. 1. Pflanzenschutz - Nachrichten Bayer 33, 47-60. (36) Gustafson D.I., Holden L.R. (1990). Non-linear pesticide dissipation in soll; a new model based on spatial variability. Environm. Sci. Technol. 24, 1032-1041.
(37) Hurle K., Walker A. (1980). Persistence and its prediction. In Interactions between Herbicides and the Soll (R.J. Hance, Ed.), Academic Press, 83-122.
Anhang 1
Wasserspannung, Feldkapazität (FK) und Wasserhaltekapazität (WHK) *
| Höhe der Wassersäule [cm] |
pFa | barb | Bemerkungen | |
| 107 | 7 | 104 | trockener Boden | |
| 1,6·104 | 4,2 | 16 | Welkepunkt | |
| 104 | 4 | 10 | ||
| 103 | 3 | 1 | ||
| 6·102 | 2,8 | 0,6 | ||
| 3,3·102 | 2,5 | 0,33c | } | |
| 102 | 2 | 0,1 | Bereich der | |
| 60 | 1,8 | 0,06 | Feldkapazitätd | |
| 33 | 1,5 | 0,033 | ||
| 10 | 1 | 0,01 | WHK (Näherungswert) | |
| 1 | 0 | 0,001 | wassergesättigter Boden | |
| a) pF = dekadischer Logarithmus der Wasserspannung (in cm Wassersäule) b) 1 bar = 105 Pa. c) entspricht einem angenäherten Wassergehalt von 10 % in Sand, 35 % in Lehm und 45 % in Ton.
d) Feldkapazität ist nicht konstant, sondern schwankt je nach Bodentyp zwischen pF 1,5 und 2,5. |
||||
Die Wasserspannung(Saugspannung) wird in cm Wassersäule oder in bar gemessen. Aufgrund des großen Saugspannungsbereichs wird sie einfach als pF-Wert angegeben, der dem Logarithmus der in cm Wassersäule angegebenen Wasserspannung entspricht.
Die Feldkapazität (Speichelfeuchte) wird definiert als die Wassermenge, die ein natürlicher Boden nach längeren Niederschlägen oder nach ausreichender Bewässerung zwei Tage gegen die Gravitation speichern kann. Sie wird in ungestörtem Boden in situ im Feld bestimmt. Daher ist die Messung nicht auf gestörte Laborbodenproben anwendbar. In gestörtem Boden bestimmte FK-Werte können erhebliche systematische Varianzen aufweisen.
Die Wasserhaltekapazitäl (WHK) wird im Labor für ungestörten und gestörten Boden durch Sättigung einer Bodensäule mit Wasser durch Kapillaraufstieg bestimmt. Sie ist besonders für gestörte Böden nützlich und kann bis zu 30 % größer sein als die Feldkapazität (1). Sie ist im Test auch leichter zu bestimmen als verlässliche FK-Werte.
Anhang 2
Bodenfeuchtegehalt (in g Wasser je 100 g Boden TG1) Verschiedener Bodenarten aus unterschiedlichen Ländern
| Bodenart | Land | Bodenfeuchtegehalt bei | ||
| WHK2 | pF = 1,8 | pF = 2,5 | ||
| Sand | Deutschland | 28,7 | 8,8 | 3,9 |
| Lehmiger Sand | Deutschland | 50,4 | 17,9 | 12,1 |
| Lehmiger Sand | Schweiz | 44,0 | 35,3 | 9,2 |
| Schluffiger Lehm | Schweiz | 72,8 | 56,6 | 28,4 |
| Toniger Lehm | Brasilien | 69,7 | 38,4 | 27,3 |
| Toniger Lehm | Japan | 74,4 | 57,8 | 31,4 |
| Sandiger Lehm | Japan | 82,4 | 59,2 | 36,0 |
| Schluffiger Lehm | USA | 47,2 | 33,2 | 18,8 |
| Sandiger Lehm | USA | 40,4 | 25,2 | 13,3 |
| 1 TG: Trockengewicht
2 Wasserhaltekapazität |
||||
Abbildung 1 Beispiel eines Durchflussapparats für die Untersuchung der Transformation von Chemikalien im Boden1,2
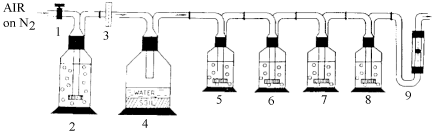
1: Nadelventil
2: mit Wasser gefüllte Gaswaschflasche
3: Ultramembran (nur sterile Bedingungen), Porengröße 0,2 µm
4: Bodenstoffwechselgefäß (mit Wasserüberstand nur für anaerobe und Reisfeldbedingungen;)
5: Ethylenglykolabscheider für flüchtige organische Verbindungen
6: Schwefelsäureabscheider für flüchtige Alkalien
7, 8: Natriumhydroxidabscheider für CO2 und andere flüchtige saure Verbindungen
9: Durchflussmesser
Abbildung 2 Beispiel eines Biometer-Gefäßes für die Untersuchung der Transformation von Chemikalien im Boden3

1) Guth, J.A. (1980). The study of transformations. In Interactions between Herbicides and the Soil (R.J. Hance, Ed.), Academic Press, 123-157.
2) Guth, J.A. (1981). Experimental approaches to studying the fitte of pesticides in soil. In Progress in Pesticide Biochemistry. D.H. Hutson, T.R. Roberts, Eds. J. Wiley & Sons. Vol 1, 85-114.
3) Anderson, J.P.E. (1975). Einfluss von Temperatur und Feuchte auf Verdampfung, Abbau und Festlegung von Diallat im Boden. Z. PflKrankh Pflschutz, Sonderheft VII, 141-146.
1) Wenn beispielsweise die Testsubstanz einen Ring enthält, muss sich die Markierung auf diesem Ring befinden; enthält die Testsubstanz zwei oder mehr Ringe, können gesonderte Untersuchungen erforderlich sein, um den Verbleib jedes markierten Ringes zu erfassen und sachgerechte Informationen zur Bildung von Transformationsprodukten zu gewinnen.
2) Die Wasserrückhalteeigenschaft eines Bodens lässt sich als Feldkapazität, als Wasserhaltekapazität oder als Wassersaugspannung (pF) messen. Erläuterungen siehe Anhang 1. Im Testbericht ist festzuhalten, ob die Wasserrückhalteeigenschaft und die Bodendichte von Böden bei ungestörten Feldproben oder gestörten (bearbeiteten) Proben ermittelt wurden.
3) Aktuelle Forschungsergebnisse deuten darauf hin, dass Böden aus den gemäßigten Klimazonen bei -20 °C sogar mehr als drei Monate gelagert werden können (28)(29), ohne dass die mikrobielle Aktivität wesentlich zurückgeht.
4) Der Boden sollte weder zu feucht noch zu trocken sein, um eine adäquate Belüftung und Ernährung der Bodenmikroflora zu gewährleisten. Für ein optimales Wachstum der Bodenmikroorganismen wird ein Feuchtegehalt von 40 - 60% der Wasserhaltekapazität (WHK) und von 0,1 - 0,33 bar empfohlen (6). Der letztere Bereich entspricht einem pF-Bereich von 2,0 - 2,5. Typische Feuchtegehalte verschiedener Bodenarten sind in Anhang 2 aufgeführt.
5) Wie ein von der EU gefördertes Forschungsprojekt gezeigt hat, herrschen in Oberböden und selbst in Böden aus Tiefenschichten aerobe Bedingungen vor IK. Takagi et al. (1992). Microbial diversity and activity in subsoils: Methods, field site, seasonal variation in subsoil temperatures and oxygen contents. Proc. Internat. Symp. Environm. Aspects Pesticides Microbiol., 270-277, 17.-21. August 1992, Sigtuna, Schwedenl. Anaerobe Bedingungen kommen nur gelegentlich bei Überschwemmungen von Böden nach schweren Niederschlägen oder bei der Herstellung von Anbaubedingungen auf Reisfeldern vor.
6) Aerobe Untersuchungen können weit vor Ablauf von 120 Tagen beendet werden, wenn zu diesem Zeitpunkt der Abbauweg eindeutig identifiziert wurde und die vollständige Mineralisation erreicht worden ist. Beendet werden kann der Test nach 120 Tagen oder wenn mindestens 90% der Testsubstanz umgewandelt sind, jedoch nur, wenn sich mindestens 5 % CO2 gebildet haben.
7) Die Berechnung der Ausgangskonzentration eines Standortes beruht auf folgender Gleichung:
| a [kg/ha] ·106[mg/kg] | ||
| CBoden[mg/kgsoil] | = | |
| l [m] ·104 [m2/ha]· d [kgsoil/m3 |
Csoil= Ausgangskonzentration im Boden [mg kg-1]
a = Aufwandrate [kg · ha-1 1; l = Dicke der Bodenschicht am Feldstandort [m]; d = Bodendichte des trockenen Bodens [kg m-3].
Als Faustregel gilt, dass eine Aufwandrate von 1 kg ha-1 in einer Bodenkonzentration von ca. 1 mg kg-1 in einer 10 cm-Schicht resultiert (ausgehend von einer Bodendichte von 1 g · cm3).
* Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt, Main.
 |
weiter . |  |
(Stand: 04.08.2022)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: ab 105.- € netto
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion