 Für einen individuellen Ausdruck passen Sie bitte die
Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2012 Tierschutz/Pflanzenschutz - EU Bund

 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 2012 Tierschutz/Pflanzenschutz - EU Bund |
 |
Durchführungsbeschluss 2012/707/EU der Kommission vom 14. November 2012 zur Festlegung eines gemeinsamen Formats für die Vorlage der Informationen gemäß der Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere
(Bekanntgegeben unter Aktenzeichen C(2012) 8064)
(Text von Bedeutung für den EWR)
(ABl. Nr. L 320 vom 17.11.2012 S. 33; ber. 2014 L 10 S. 18;
Beschl. (EU) 2020/569 - ABl. L 129 vom 24.04.2020 S. 16, ber. L 211 S. 22aufgehoben)
aufgehoben/ersetzt gem. Art. 5 des Beschl.'es (EU) 2020/569
| Ergänzende Informationen |
| Umsetzung in deutsches Recht: VO zur Ablösung der Versuchstiermeldeverordnung und zur Änderung tierschutzrechtlicher Vorschriften |
Die Europäische Kommission -
gestützt auf den Vertrag über die Arbeitsweise der Europäischen Union,
gestützt auf die Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates vom 22. September 2010 zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere 1, insbesondere auf Artikel 54 Absatz 4,
in Erwägung nachstehender Gründe:
(1) Die in der Richtlinie 2010/63/EU vorgesehene Harmonisierung einzelstaatlicher Rechtsvorschriften ist erforderlich, um das Wohlergehen von Tieren, die zu wissenschaftlichen Zwecken verwendet werden, zu verbessern, und hat zum Ziel, eine derartige Verwendung von Tieren zu vermeiden, zu vermindern und zu verbessern.
(2) Gemäß Artikel 54 Absatz 1 der Richtlinie 2010/63/EU übermitteln die Mitgliedstaaten der Kommission bis zum 10. November 2018 und danach alle fünf Jahre Informationen über die Durchführung der genannten Richtlinie.
(3) Gemäß Artikel 54 Absatz 2 der Richtlinie 2010/63/EU erfassen die Mitgliedstaaten jedes Jahr statistische Daten über die Verwendung von Tieren in Verfahren und stellen diese öffentlich zur Verfügung. Die Mitgliedstaaten legen der Kommission diese statistischen Daten bis zum 10. November 2015 sowie danach jedes Jahr vor.
(4) Gemäß Artikel 54 Absatz 3 der Richtlinie 2010/63/EU legen die Mitgliedstaaten der Kommission jedes Jahr ausführliche Informationen über Ausnahmen vor, die nach Artikel 6 Absatz 4 Buchstabe a der Richtlinie gewährt wurden.
(5) Im Interesse der einheitlichen Durchführung der Richtlinie sollte ein gemeinsames Format für die Vorlage der Informationen gemäß Artikel 54 Absätze 1, 2 und 3 der Richtlinie 2010/63/EU festgelegt werden.
(6) Damit die Informationen über die Durchführung der Richtlinie 2010/63/EU vergleichbar sind und die Kommission die Wirksamkeit der Richtliniendurchführung auf EU-Ebene bewerten kann, sollten die Datenvorlagen der Mitgliedstaaten über die Durchführung der Richtlinie, die Jahresstatistiken über die Verwendung von Tieren in Verfahren und die gemäß Artikel 6 Absatz 4 Buchstabe a gewährten Ausnahmen akkurat und kohärent sein; die Berichtspflichten sollten daher durch die Festlegung eines gemeinsamen Formats für die Vorlage dieser Informationen EU-weit harmonisiert werden.
(7) Auf der Grundlage der von den Mitgliedstaaten gemäß Artikel 54 Absatz 2 der Richtlinie 2010/63/EU eingereichten statistischen Daten legt die Kommission dem Europäischen Parlament und dem Rat gemäß Artikel 57 Absatz 2 der Richtlinie einen zusammenfassenden Bericht zu diesen Daten vor. Damit die Daten aussagekräftig, akkurat und vergleichbar sind, ist es unerlässlich, dass sie nach einem für alle Mitgliedstaaten einheitlichen Format mitgeteilt werden.
(8) Damit die Liste der Methoden zur Tötung von Tieren gemäß Anhang IV der Richtlinie 2010/63/EU stets aktuell ist und den neuesten wissenschaftlichen Erkenntnissen Rechnung trägt, müssen ausführliche Informationen über gemäß Artikel 6 Absatz 4 Buchstabe a der Richtlinie ausnahmsweise zugelassene Methoden übermittelt werden.
(9) Die in diesem Beschluss vorgesehenen Maßnahmen entsprechen der Stellungnahme des gemäß Artikel 56 Absatz 3 der Richtlinie 2010/63/EU eingesetzten Ausschusses
- hat folgenden Beschluss erlassen:
Die Mitgliedstaaten übermitteln die Informationen gemäß Artikel 54 Absatz 1 der Richtlinie 2010/63/EU nach dem gemeinsamen Berichtsformat gemäß Anhang I dieses Beschlusses.
Die Mitgliedstaaten übermitteln die statistischen Daten gemäß Artikel 54 Absatz 2 der Richtlinie 2010/63/EU nach dem gemeinsamen Berichtsformat und den ausführlichen Anweisungen gemäß Anhang II dieses Beschlusses.
Die Mitgliedstaaten übermitteln die in Artikel 54 Absatz 3 der Richtlinie 2010/63/EU vorgesehenen Informationen über die gemäß Artikel 6 Absatz 4 Buchstabe a der Richtlinie gewährten Ausnahmen in dem gemeinsamen Berichtsformat gemäß Anhang III dieses Beschlusses.
Dieser Beschluss ist an die Mitgliedstaaten gerichtet.
Brüssel, den 14. November 2012
| Anhang I |
Berichtsformat für die Vorlage der Informationen gemäss Artikel 54 Absatz 1 der Richtlinie 2010/63/EU
Angaben zu bestimmten Vorkommnissen (z.B. Zahlen) sind entweder als Momentaufnahmen für das letzte Jahr des Fünfjahreszyklus oder ausnahmsweise für den gesamten Fünfjahreszyklus, aufgeschlüsselt nach Jahren, zu erfassen.
A. Allgemeine Informationen
Änderungen einzelstaatlicher Maßnahmen in Bezug auf die Durchführung der Richtlinie 2010/63/EU seit dem letzten Bericht.
B. Strukturen und Rahmenvorschriften
Informationen über die Rahmenregelung für zuständige Behörden, einschließlich Zahl und Art dieser Behörden.
Informationen über die Mindestanforderungen gemäß Artikel 23 Absatz 3 der Richtlinie 2010/63/EU, einschließlich etwaiger zusätzlicher Ausbildung und Schulung für Personal aus anderen Mitgliedstaaten.
Beschreibung der Verfahren der Projektbeurteilung und Projektgenehmigung und der Art und Weise der Erfüllung der Anforderungen von Artikel 38 und 40 der Richtlinie 2010/63/EU.
C. Durchführung
Informationen über die Zahl der jährlich genehmigten Projekte und über die Zahl und Art der Projekte, die unter eine Genehmigung für "mehrere gleichartige Projekte" fallen;
Informationen über den Anteil an den gesamten Genehmigungen, bei dem die 40-Tage-Frist gemäß Artikel 41 Absatz 2 der Richtlinie 2010/63/EU verlängert wurde, und über die Umstände, die dies begründen.
Informationen über die Funktionsweise nichttechnischer Projektzusammenfassungen, über das Verfahren, mit dem sichergestellt wird, dass die Anforderungen von Artikel 43 Absatz 1 der Richtlinie 2010/63/EU erfüllt sind, sowie darüber, ob die nichttechnischen Projektzusammenfassungen Angaben zu Projekten enthalten werden, die für eine rückblickende Bewertung (Artikel 43 Absatz 2 der Richtlinie 2010/63/EU) ausgewählt wurden;
Informationen über Anteil und Art der Projekte, die zusätzlich zu den Projekten, für die eine rückblickende Bewertung gemäß Artikel 39 Absatz 2 der Richtlinie verbindlich ist, für eine rückblickende Bewertung im Rahmen von Artikel 38 Absatz 2 Buchstabe f der Richtlinie 2010/63/EU vorgelegt wurden.
Informationen über die Umstände, unter denen Ausnahmen gemäß Artikel 10 Absatz 3, Artikel 12 Absatz 1 und Artikel 33 Absatz 3 der Richtlinie 2010/63/EU genehmigt wurden, und insbesondere Informationen über die Ausnahmefälle gemäß Artikel 16 Absatz 2 der Richtlinie, in denen während des Berichtszeitraums die erneute Verwendung eines Tieres nach einem Verfahren, bei dem das tatsächliche Leiden des Tieres als schwer eingestuft wurde, genehmigt wurde.
Informationen über Struktur und Tätigkeit von Tierschutzgremien.
D. Grundsatz der Vermeidung, Verminderung und Verbesserung
Die allgemeinen Maßnahmen, die getroffen wurden um sicherzustellen, dass der Grundsatz der Vermeidung, Verminderung und Verbesserung bei genehmigten Projekten sowie bei der Unterbringung und Pflege der Tiere, auch in Zucht- und Lieferantenbetrieben, angemessen angewendet wird.
Allgemeine Beschreibung der Maßnahmen, die getroffen wurden um sicherzustellen, dass Verfahren nicht doppelt durchgeführt werden.
repräsentative Informationen über die ungefähren Tierzahlen, die verwendeten Tierarten und die Arten von Methoden für die Entnahme von Gewebeproben (mit Angabe des Schweregrades) zur genetischen Charakterisierung mit und ohne Projektgenehmigung, wobei die Angaben für das dem Jahr der Vorlage des Fünfjahresberichts vorangehende Kalenderjahr vorzulegen sind, sowie Informationen über die getroffenen Maßnahmen zur Verfeinerung dieser Methoden.
E. Durchsetzung
Zahl der aktiven zugelassenen Züchter, Lieferanten und Verwender; Informationen über Aussetzung und Entzug von Züchter-, Lieferanten- und Verwenderzulassungen mit Angabe der Gründe dafür.
Quantitative und qualitative Informationen zu Arbeitsabläufen, einschließlich der im Rahmen von Artikel 34 Absatz 2 der Richtlinie 2010/63/EU angewandten Kriterien, und des Anteils unangekündigter Inspektionen, aufgeschlüsselt nach Jahren.
Informationen über den Entzug von Projektgenehmigungen während des Berichtszeitraums, mit Angabe der Gründe dafür.
Informationen über die Art der Verstöße sowie über die eingeleiteten rechtlichen und administrativen Maßnahmen während des Berichtszeitraums.
| Anhang II 14 |
Teil A
Flussdiagramm der Kategorien für die Eingabe statistischer Daten gemäss Artikel 54 Absatz 2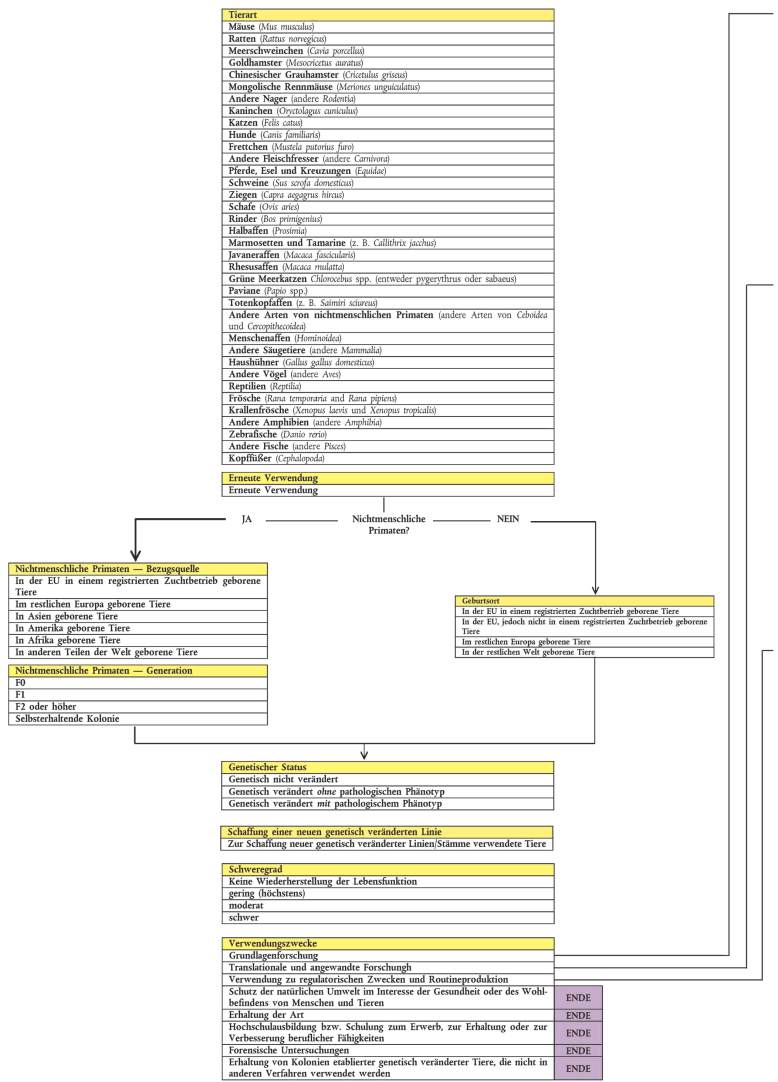

Teil B
Ausführliche Anweisungen für die Angabe statistischer Daten über die Verwendung von Tieren für wissenschaftliche Zwecke gemäss Artikel 54 Absatz 2
Berichtsformat für die Vorlage der Informationen gemäss Artikel 54 Absatz 2 der Richtlinie 2010/63/EU
A. Genetisch veränderte Tiere
B. Datenkategorien
Die folgenden Abschnitte folgen der Reihenfolge der Kategorien und der diesbezüglichen Überschriften im Flussdiagramm.
1. Tierarten
Da bestimmte Fisch- und Kopffüßerarten sehr klein sind, kann die Zählung auf Basis von Schätzwerten erfolgen.
2. Erneute Verwendung
Erneute Verwendung versus kontinuierliche Verwendung
Bei einem Verfahren wird ein Tier für einen einzigen wissenschaftlichen/Versuchs-/Lehr- oder Schulungszweck verwendet. Eine einmalige Verwendung läuft ab dem Zeitpunkt, an dem der erste technische Eingriff am Tier vorgenommen wird, bis zum Abschluss der Datenerfassung und der Beobachtungen oder bis zum Erreichen des Lehrziels. Gewöhnlich handelt es sich um einen einzigen Versuch, einen einmaligen Test oder eine einmalige Übung einer Technik.
Ein einziges Verfahren kann verschiedene Schritte (Techniken) beinhalten, die logischerweise alle ein bestimmtes Ergebnis zum Ziel haben und die Verwendung ein und desselben Tieres voraussetzen.
Der Endverwender meldet das gesamte Verfahren einschließlich etwaiger Vorbereitungsarbeiten (ungeachtet des Standorts dieser Arbeiten) und berücksichtigt dabei den Schweregrad der Vorbereitung.
Beispiele für Vorbereitungsarbeiten sind u. a. chirurgische Eingriffe (wie das Legen von Kanülen, Telemetrie-Implantate, Ovarektomien, Kastrationen, Hypophysektomien usw.) und nichtchirurgische Eingriffe (wie die Verabreichung modifizierter Nahrung, das Auslösen von Diabetes usw.). Dasselbe gilt für die Zucht genetisch veränderter Tiere, d. h., wenn das Tier in dem vorgesehenen Verfahren verwendet wird, muss der Endverwender das gesamte Verfahren unter Berücksichtigung des mit dem Phänotyp einhergehenden Schweregrads melden. Für genauere Einzelheiten siehe Abschnitt über genetisch veränderte Tiere.
Wird ein vorbereitetes Tier aus außergewöhnlichen Gründen nicht für einen wissenschaftlichen Zweck verwendet, so sollte die Einrichtung, die das Tier vorbereitet hat, die Einzelheiten der Vorbereitung unter den statistischen Daten je nach vorgesehenem Verwendungszweck als eigenständiges Verfahren erfassen, vorausgesetzt, bei der Vorbereitung des Tieres wurde die Mindestschwelle für Schmerzen, Leiden, Ängste und dauerhaften Schaden überschritten.
3. Geburtsort
| In der EU in einem registrierten Zuchtbetrieb geborene Tiere |
| In der EU, jedoch nicht in einem registrierten Zuchtbetrieb geborene Tiere |
| Im restlichen Europa geborene Tiere |
| In der restlichen Welt geborene Tiere |
4. Nichtmenschliche Primaten - Bezugsquelle
| In der EU in einem registrierten Zuchtbetrieb geborene Tiere |
| Im restlichen Europa geborene Tiere |
| In Asien geborene Tiere |
| In Amerika geborene Tiere |
| In Afrika geborene Tiere |
| In anderen Teilen der Welt geborene Tiere |
Für die Zwecke dieser Berichterstattung sind
Die Herkunft von Tieren, die unter ,In anderen Teilen der Welt geborene Tiere' erfasst sind, müssen der zuständigen Behörde im Rahmen der Datenübermittlung mitgeteilt werden.
5. Nichtmenschliche Primaten - Generation
| F0 |
| F1 |
| F2 oder höher |
| Selbsterhaltende Kolonie |
6. Genetischer Status
| Genetisch nicht verändert |
| Genetisch verändert ohne pathologischen Phänotyp |
| Genetisch verändert mit pathologischem Phänotyp |
7. Schaffung einer neuen genetisch veränderten Linie
| Zur Schaffung neuer genetisch veränderter Linien/Stämme verwendete Tiere |
Zur ,Schaffung neuer genetisch veränderter Linien/Stämme verwendete Tiere' sind Tiere, die zur Schaffung einer (eines) neuen genetisch veränderten Linie/Stamms verwendet und von anderen Tieren, die der ,Grundlagenforschung' oder der ,Translationalen und angewandten Forschung' vorbehalten sind, zu unterscheiden sind.
8. Schweregrad
9. Verwendungszwecke
| Grundlagenforschung |
| Translationale und angewandte Forschung |
| Verwendung zu regulatorischen Zwecken und Routineproduktion |
| Schutz der natürlichen Umwelt im Interesse der Gesundheit oder des Wohlbefindens von Menschen und Tieren |
| Erhaltung der Art |
| Hochschulausbildung bzw. Schulung zum Erwerb, zur Erhaltung oder zur Verbesserung beruflicher Fähigkeiten |
| Forensische Untersuchungen |
| Erhaltung von Kolonien etablierter genetisch veränderter Tiere, die nicht in anderen Verfahren verwendet werden |
Unter Grundlagenforschung fallen fundamentale Untersuchungen, auch physiologischer Art, Untersuchungen zur weiteren Erforschung normaler und abnormaler Strukturen, der Funktionsweise und des Verhaltens lebender Organismen und der Umwelt (einschließlich fundamentale toxikologische Untersuchungen) sowie Untersuchungen und Analysen, die eher auf ein besseres oder genaueres Verständnis eines Themas, Phänomens oder grundlegenden Naturgesetzes als auf die spezifische praktische Anwendung der Ergebnisse ausgerichtet sind.
Tiere, die zur Schaffung einer neuen genetisch veränderten und zu Zwecken der Grundlagenforschung (z.B. Entwicklungsbiologie, Immunologie) bestimmten Tierlinie (einschließlich der Kreuzung zweier Linien) verwendet werden, sollten entsprechend der Zweckbestimmung, für die sie geschaffen wurden, erfasst werden. Sie sollten außerdem unter ,Schaffung einer neuen genetischen Linie - Zur Schaffung neuer genetisch veränderter Linien/Stämme verwendete Tiere' eingetragen werden.
Alle Tiere mit verändertem Erbgut sollten während der Schaffung einer neuen Linie erfasst werden. Auch Tiere, die im Rahmen der Schaffung für Superovulationen, Vasektomien und Embryo-Implantationen verwendet werden, sind hier zu erfassen. Die Berichterstattung sollte genetisch nicht veränderte Nachkommen (Wildtypen) ausschließen.
Ein neuer Stamm oder eine neue Linie genetisch veränderter Tiere gilt als ,etabliert', wenn sich das veränderte Erbgut stabilisiert hat, was nach frühestens zwei Generationen der Fall ist, und wenn eine Tierschutzbewertung abgeschlossen wurde.
Im Rahmen der translationalen und angewandten Forschung werden Tiere für die Zwecke gemäß Artikel 5 Buchstaben b und c verwendet, Verwendungen zu regulatorischen Zwecken ausgenommen.
Hierunter fallen auch forschungsorientierte Toxikologie sowie Untersuchungen zur Vorbereitung von Anträgen auf regulatorische Zulassung und zur Methodenentwicklung. Die für die Anträge auf regulatorische Zulassung als solche erforderlichen Studien fallen nicht darunter.
Tiere, die zurSchaffung einer neuen genetisch veränderten und zu Zweckender translationalen und angewandten Forschung (z.B. zur Krebsforschung oder Impfstoffentwicklung) bestimmten Tierlinie (einschließlich der Kreuzung zweier Linien) verwendet werden, solltenentsprechend der Zweckbestimmung, für die sie geschaffen wurden, erfasst werden. Sie sollten auch unter ,Schaffung einer neuen genetischen Linie - Zur Schaffung neuer genetisch veränderter Linien/Stämme verwendete Tiere' eingetragen werden.
Alle Tiere mit verändertem Erbgut sollten während der Schaffung einer neuen Linie erfasst werden. Auch Tiere, die im Rahmen der Schaffung für Superovulationen, Vasektomien und Embryo-Implantationen verwendet werden, sind hier zu erfassen. Die Berichterstattung sollte genetisch nicht veränderte Nachkommen (Wildtypen) ausschließen.
Ein neuer Stamm oder eine neue Linie genetisch veränderter Tiere gilt als ,etabliert', wenn sich das veränderte Erbgut stabilisiert hat, was nach frühestens zwei Generationen der Fall ist, und wenn eine Tierschutzbewertung abgeschlossen wurde.
Verwendung von Tieren in Verfahren, die zur Erfüllung gesetzlicher Auflagen für die Herstellung von Produkten/ Stoffen und deren Einführung und Erhaltung auf dem Markt durchgeführt werden, einschließlich Unbedenklichkeits- und Risikobewertungen von Nahrungs- und Futtermitteln. Hierunter fallen auch Tests von Produkten/Stoffen, für die letztlich keine Anträge auf regulatorische Zulassung gestellt werden, sofern diese Tests Teil eines Antrags auf regulatorische Zulassung gewesen wären, wenn ein solcher Antrag gestellt worden wäre (d. h. Tests an Produkten/Stoffen, die das Ende ihres Entwicklungsprozesses nicht erreichen).
Hierunter fallen auch Tiere, die im Rahmen der Herstellung von Produkten verwendet wurden, wenn der Herstellungsprozess eine regulatorische Zulassung vorsieht (Tiere, die für die Herstellung von Arzneimitteln auf Serumbasis verwendet werden, sollten beispielsweise unter dieser Kategorie erfasst werden).
Die während der Entwicklung eines neuen Medizinproduktes durchgeführten Wirksamkeitsprüfungen fallen nicht darunter; sie sollten unter der Kategorie ,Translationale und angewandte Forschung' erfasst werden.
Hierunter fallen Studien zur Untersuchung und zum Verständnis von Phänomenen wie Umweltverschmutzung und Biodiversitätsverluste sowie epidemiologische Studien über Wildtiere.
Regulatorische Verwendungen von Tieren für ökotoxikologische Zwecke fallen nicht darunter.
Hierunter fallen Schulungen zum Erwerb und zur Erhaltung praktischer technischer Fähigkeiten, wie in Artikel 23 Absatz 2 vorgesehen.
Hierunter ist die Zahl der Tiere einzutragen, die benötigt werden, um Kolonien genetisch veränderter Tiere etablierter Linienmit einem beabsichtigt pathologischen Phänotyp zu erhalten, und die als Folge des pathologischen Genotyps Schmerzen, Leiden, Ängste oder dauerhafte Schäden gezeigt haben. Der Verwendungszweck, für den die Linie gezüchtet wird, braucht nicht erfasst zu werden.
Tiere, die für dieSchaffung einer neuen genetisch veränderten Linie benötigt werden, sowie Tiere, die inanderen Verfahren (ausgenommen Entwicklungs-/Zuchtprojekte) verwendet werden, fallen nicht darunter.
10. Untersuchungen im Rahmen der Grundlagenforschung
| Onkologie |
| Kardiovaskuläres System (Blut- und Lymphgefäße) |
| Nervensystem |
| Atmungssystem |
| Gastrointestinales System, einschließlich Leber |
| Muskuloskelettales System |
| Immunsystem |
| Urogenitales/Fortpflanzungssystem |
| Sinnesorgane (Haut, Augen und Ohren) |
| Endokrines System/Stoffwechsel |
| Multisystemisch |
| Ethologie/Tierverhalten/Tierbiologie |
| Andere |
Hierunter sollten ungeachtet des Zielsystems alle Untersuchungen im Rahmen der Krebsforschung angegeben werden.
Unter diese Kategorie fallen Neurowissenschaft, peripheres oder zentrales Nervensystem, Psychologie.
Untersuchungen der Nase sollten unter ,Atmungssystem' eingetragen werden, Untersuchungen der Zunge unter ,Gastrointestinales System, einschließlich Leber'.
Hierunter sollten nur Forschungsarbeiten erfasst werden, bei denen mehr als ein System von überragendem Interesse ist, wie dies bei bestimmten Infektionskrankheiten der Fall ist; die Krebsforschung fällt nicht darunter.
Hierunter sind Forschungsarbeiten zu erfassen, die sich nicht auf eines der vorgenannten Organe/Systeme beziehen oder die nicht organ-/systemspezifisch sind.
Tiere, die zur Herstellung und Erhaltung von Krankheitserregern, Vektoren und Neoplasmen und für die Gewinnung von anderem biologischen Material verwendet werden, sowie Tiere, die für die Herstellung polyklonaler Antikörper im Rahmen der translationalen/angewandten Forschung benötigt werden - die Herstellung monoklonaler Antikörper im Aszites-Verfahren (die unter die Kategorie ,Verwendung zu regulatorischen Zwecken und Routineproduktion, nach Typ' fällt) ausgenommen -, sollten in den jeweiligen Feldern der Kategorien ,Untersuchungen im Rahmen der Grundlagenforschung' oder ,Translationale und angewandte Forschung' erfasst werden. Der Zweck der Untersuchungen muss genau festgestellt werden, denn es könnten Eintragungen unter zwei Kategorien möglich sein und nur der Hauptuntersuchungszweck sollte angegeben werden.
11. Translationale und angewandte Forschung
| Krebserkrankungen des Menschen |
| Infektionskrankheiten des Menschen |
| Kardiovaskuläre Erkrankungen des Menschen |
| Nerven- und Geisteserkrankungen des Menschen |
| Atemwegserkrankungen des Menschen |
| Gastrointestinale Erkrankungen des Menschen, einschließlich der Leber |
| Muskuloskelettale Erkrankungen des Menschen |
| Immunerkrankungen des Menschen |
| Erkrankungen des urogenitalen/des Fortpflanzungssystems des Menschen |
| Erkrankungen der Sinnesorgane des Menschen (Haut, Augen und Ohren) |
| Erkrankungen des endokrinen Systems/des Stoffwechselsystems des Menschen |
| Andere Humanerkrankungen |
| Tiererkrankungen und -krankheiten |
| Tierschutz |
| Krankheitsdiagnose |
| Pflanzenkrankheiten |
| Nicht regulatorische Toxikologie und Ökotoxikologie |
Tiere, die zur Herstellung und Erhaltung von Krankheitserregern, Vektoren und Neoplasmen und für die Gewinnung von anderem biologischen Material verwendet werden, sowie Tiere, die für die Herstellung polyklonaler Antikörper im Rahmen der translationalen/angewandten Forschung benötigt werden (die Herstellung monoklonaler Antikörper im Aszites-Verfahren (die unter die Kategorie ,Verwendung zu regulatorischen Zwecken und Routineproduktion, nach Typ' fällt) ausgenommen), sollten in den jeweiligen Feldern der Kategorien ,Untersuchungen im Rahmen der Grundlagenforschung' oder ,Translationale und angewandte Forschung' erfasst werden. Der Zweck der Untersuchungen muss genau festgestellt werden, denn es könnten Eintragungen unter zwei Kategorien möglich sein und nur der Hauptuntersuchungszweck sollte angegeben werden.
12. Verwendung zu regulatorischen Zwecken und Routineproduktion
13. Verwendung zu regulatorischen Zwecken und Routineproduktion, nach Typ
| Qualitätskontrolle (einschließlich Chargenunbedenklichkeit und -potenzprüfungen) |
| Andere Wirksamkeits- und Toleranzprüfungen |
| Toxizitäts- und andere Unbedenklichkeitsprüfungen, einschließlich pharmakologischer Tests |
| Routineproduktion |
14. Prüfungen aufgrund von Rechtsvorschriften
| Vorschriften für Humanarzneimittel |
| Vorschriften für Tierarzneimittel und ihre Rückstände |
| Vorschriften für Medizinprodukte |
| Vorschriften für Industriechemikalien |
| Vorschriften für Pflanzenschutzmittel |
| Vorschriften für Biozidprodukte |
| Vorschriften für Lebensmittel, einschließlich Materialien, die mit Lebensmitteln in Berührung kommen |
| Vorschriften für Futtermittel, einschließlich Vorschriften für die Sicherheit von Zieltieren, Arbeitnehmern und Umwelt |
| Vorschriften für Kosmetikprodukte |
| Andere |
15. Anforderungen aufgrund von Rechtsvorschriften
| Vorschriften, die EU-Anforderungen erfüllen |
| Vorschriften, die nur nationale Anforderungen erfüllen (EU-intern) |
| Vorschriften, die EU-externe Anforderungen erfüllen |
16. Qualitätskontrolle (einschließlich Chargenunbedenklichkeit und -potenzprüfungen)
| Chargenunbedenklichkeitsprüfungen |
| Pyrogenitätsprüfungen |
| Chargenpotenzprüfungen |
| Andere Qualitätskontrollen |
Chargenunbedenklichkeitsprüfungen schließen Pyrogenitätsprüfungen aus. Diese sind unter der separaten Kategorie Pyrogenitätsprüfungen zu erfassen.
17. Toxizitäts- und andere Unbedenklichkeitsprüfungen, nach Prüfungstypen
| Testmethoden zur Prüfung auf akute Toxizität (bei einmaliger Verabreichung) (einschließlich Limit-Test) |
| Hautreizung/-ätzung |
| Hautsensibilisierung |
| Augenreizung/-ätzung |
| Toxizität bei wiederholter Applikation |
| Karzinogenität |
| Gentoxizität |
| Reproduktionstoxizität |
| Entwicklungstoxizität |
| Neurotoxizität |
| Kinetik (Pharmakokinetik, Toxikokinetik, Rückstandsabbau) |
| Pharmakodynamik (einschließlich Sicherheitspharmakologie) |
| Fototoxizität |
| Ökotoxizität |
| Unbedenklichkeitsprüfung von Nahrungs- und Futtermitteln |
| Unbedenklichkeit für Zieltiere |
| Andere |
18. Akute und subakute Toxizität - Testmethoden
| LD50, LC50 |
| Andere letale Methoden |
| Nichtletale Methoden |
19. Toxizität bei wiederholter Applikation
| < und 28 Tage |
| 29-90 Tage |
| > 90 Tage |
20. Verwendung von Tieren zur regulierten Produktion, nach Produkttypen
| Produkte auf Blutbasis |
| Monoklonale Antikörper |
| Andere |
21. Ökotoxizität
| Akute Toxizität |
| Chronische Toxizität |
| Reproduktionstoxizität |
| Endokrine Wirkung |
| Bioakkumulation |
| Andere |
C. Anmerkungen des Mitgliedstaats
| Anhang III |
Berichtsformat für die Vorlage der in Artikel 54 Absatz 3 der Richtlinie 2010/63/EU vorgesehenen Informationen über die gemäss Artikel 6 Absatz 4 Buchstabe a der Richtlinie gewährten Ausnahmen
| Art der Methode | Tierart | Begründung |
 |
ENDE |  |
(Stand: 28.08.2025)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: ab 105.- € netto (Grundlizenz)
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion