2-Naphthylamino-1-sulfonsäure
Tobiassäure
1 mg/m3 = 0,108 ml/m3 (ppm)
| zurück |
2-Aminonaphthalin-1-sulfonsäure
(CAS-Nr.: 81-16-3)
Ausgabe: Januar 2006
Stand: Februar 1993
Spitzenbegrenzung: Kategorie II,1
1 Substanzcharakteristik
| Substanzname: | 2-Amino-1-naphthalinsulfonsäure |
| Synonyma: | 2-Aminonaphthalin-1-sulfonsäure
2-Naphthylamino-1-sulfonsäure Tobiassäure |
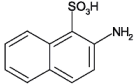
| Strukturformel: |  |
| Summenformel: | C10H9NO3S |
| CAS-Nummer: | 81-16-3 |
| EG-Nummer: | |
| molare Masse: | 223,2 g/mol |
| Schmelzpunkt: | nicht anwendbar ab 100°C Zersetzung unter 2-Naphthylamin-Abspaltung |
| Siedepunkt: | nicht anwendbar |
| Flammpunkt: | nicht anwendbar |
| Dampfdruck: | nicht anwendbar |
| Luftsättigungskonzentration: | nicht anwendbar |
| spezifisches Gewicht: | |
| Schüttdichte: | 0,5 g/cm3 (25°C) |
| Löslichkeit: | 1,81 g/l Wasser (20°C); sehr geringe Löslichkeit in Alkohol und Ether |
| n-Octanol-Wasser-Verteilungskoeffizient: | nicht anwendbar |
| Aussehen: | beigefarbenes Pulver; kristallisiert in Form von weißen Nadeln |
| Umrechnungsfaktoren (20°C): | 1 ml/m3 (ppm) = 9,261 mg/m3
1 mg/m3 = 0,108 ml/m3 (ppm) |
2 Grenzwerte, Einstufungen, Regelungen Keine Informationen vorhanden
3 Herstellung und Verwendung
Tobiassäure wird durch Sulfonierung von 2-Naphthol und nachfolgende Umsetzung mit Ammoniak hergestellt. Es stellt als Ersatzsubstanz für β-Naphthylamin ein Ausgangsprodukt für verschiedene chemische Synthesen, besonders bei der Synthese von Farbstoffen, dar.
4 Analytische Bestimmungsmethode
| Probenahme: | Adsorption an Kieselgel SKC 700/300 mg | 10 min |
| Pumpe: | DuPont 2500 S(1-2 l/min, Staubkriterien beachten) | |
| Desorption: | 3 ml Desorptionslösung (Acetonitril/Wasser 1:1) | |
| HPLC-Bestimmung | Ultraschall 45 min schütteln : Stahlsäule, 0,25 m, Durchmesser 8 mm Füllung ET 250/8/4 auf Nucleosil 120-5 C 18 Eluent 600 ml Wasser 300 ml Acetonitril 5 ml H2SO4 (10 %ig) 2 g Tetrabutylammoniumbromid Flussrate 1 ml/min Injektionsvolumen 20 µl UV-Detektor (DAD) Absorption bei 242 nm |
|
| Kalibrierung: | externer Standard | |
| Bestimmungsgrenze: | 0,1 mg/m3 bei 100 l Probeluft |
5 Metabolismus, Toxikokinetik
35S-Tobiassäure wurde männlichen Sprague-Dawley-Ratten in einer Einzeldosis von 1 mg/kg KGW intravenös oder per Schlundsonde verabreicht.Die Tobiassäure wurde zum größten Teil innerhalb von 24 Stunden unverändert aus dem Körper ausgeschieden, und zwar nach intravenöser Gabe fast ausschließlich mit dem Harn, nach oraler Gabe etwa zur Hälfte mit dem Harn und zur Hälfte mit den Faeces. Zwischen 69 % und 88 % der applizierten Tobiassäure wurden wiedergefunden.Chromatographische Untersuchungen ergaben keinen Hinweis auf eine Freisetzungvon β-Naphthylamin. Um die Methode noch empfindlicher zu machen empfehlen die Autoren, entsprechende Untersuchungen mit Ringmarkierter Tobiassäure durchzuführen [1].
Eine Metabolisierung von Tobiassäure in ein Kanzerogen wäre theoretisch neben einer Abspaltung der SO3H-Gruppe auch durch eine N-Hydroxylierung denkbar.Eine Verfütterung von Tobiassäure an Hunde zeigte, dass die Substanzschnell resorbiert und ausgeschieden wird. Die Konzentration von β-Naphthylamin war im Harn der behandelten Hunde ähnlich wie indem der Kontroll-Hunde; es ergaben sich keine Anzeichen für eine N-Hydroxylierung der Tobiassäure (keine näheren Angaben) [2].
In einer Arbeit wird gezeigt, dass die Tobiassäure bei Hunden nach oraler Gabe von β-Naphthylamin als Metabolit im Urin ausgeschieden wird [3].
6 Erfahrungen am Menschen
Bei 19 Chemiearbeitern, die über einen Zeitraum von 6,5 " 5,7 Jahrenberuflich gegenüber Tobiassäure exponiert waren, lag die Lymphozyten-Reaktivität gegenüber Harnblasen-Tumorzellen im Bereich der Kontrollen, während bei ß-Naphthylaminexponierten Personen die Lymphozyten-Reaktivität deutlich erhöht war [2].
7 Experimentelle Toxizitätsdaten
7.1 Akute Toxizität, lokale Verträglichkeit, Sensibilisierung
7.1.1 Akute Toxizität
Die Daten zur akuten Toxizität von Tobiassäure sind in der Tabelle 1 zusammengestellt.
Tabelle 1: Daten zur akuten Toxizität von Tobiassäure
| Spezies | Geschl. | Applikationsweg | LD50/LC50 | Ref. |
| Ratte | ? | oral | 19.400 mg/kg KGW | [4] |
| Ratte | m, w | oral > | 5000 mg/kg KGW | [5] |
| Ratte | m, w | dermal > | 2000 mg/kg KGW | [6] |
| Ratte | m, w | inhalativ > | 5333 mg/m3/4h* | [7] |
| * Staubinhalation (dynamische Kopf-Nasen-Exposition) | ||||
Nach einmaliger oraler Gabe von 5000 mg/kg KGW wurden bei Ratten folgende Vergiftungssymptome festgestellt: gesträubtes Fell, schlechter Allgemeinzustand, Schnappatmung, vermehrter Speichelfluss und Sedation;Todesfälle traten nicht auf. Alle am Ende der 14-tägigen Nachbeobachtungszeit getöteten Tiere waren pathologischanatomisch unauffällig [5].
Nach dermaler Applikation (okklusiv; Einwirkzeit 24 Stunden) von 2000 mg/kgKGW zeigten einige Tiere ein leichtes Zittern. Lokale Hautveränderungen oder Todesfälle traten nicht auf. Bei den männlichen Tieren war das Körperwachstum verzögert und die Weibchen zeigten in der 1.Versuchswoche einen geringfügigen Gewichtsverlust. Alle am Ende der 14-tägigen Nachbeobachtungszeit getöteten Tiere waren pathologisch-anatomisch unauffällig [6].
Die 4-stündige Kopf-Nase-Exposition gegenüber 5333 mg Tobiassäure-Staub/m3 wurde von Ratten beiderlei Geschlechts ohne Todesfälle und symptomlos vertragen. Die Körpergewichtsentwicklung war jedoch bei einigen Tieren marginal beeinträchtigt. Alle am Ende der 14-tägigen Nachbeobachtungszeit getöteten Tiere waren pathologisch-anatomisch unauffällig [7].
7.1.2 Lokale Verträglichkeit
In einer gemäß den derzeit gültigen Richtliniendurchgeführten Studie wirkt Tobiassäure nicht reizend an Haut und Auge von Kaninchen [8].
In einer älteren Veröffentlichung [4] wird Tobiassäure als nicht reizend an der Kaninchenhaut und leicht reizend am Kaninchenauge beschrieben.
7.1.3 Sensibilisierung Keine Informationen vorhanden
7.2 Subakute, subchronische Toxizität Keine Informationen vorhanden
7.3 Chronische Toxizität, Kancerogenität
Im Rahmen einer Kancerogenese-Studie erhielten je 50 männliche und 50 weibliche BALB/c-Mäuse über einen Zeitraum von 66 Wochen Futtermit einem Tobiassäure-Gehalt von 0; 2500; 5000 bzw. 10.000 ppm, entsprechend einer Wirkstoffaufnahme von ca. 0; 375; 750 bzw. 1500 mg/kg KGW/Tag. Am Ende der 66-wöchigen Nachbeobachtungszeit, in der alle Tiere die Kontrolldiät erhielten, wurden alle überlebenden Tiere getötet. Die Körpergewichtsentwicklung und die Überlebensrate zeigten keine signifikanten Abweichungen von den Kontrollen. Die Art und Inzidenz der beobachteten Tumoren war mit den Kontrollwerten vergleichbar (siehe Tabelle 2); Harnblasen-Tumoren traten nicht auf [9].
Tabelle 2: Tumorinzidenzen (in %) bei BALB/c-Mäusen nach 66-wöchiger Gabe von Tobiassäure im Futter (nach Ref. [9])
| Dosis (ppm) | 0 | 2500 | 5000 | 10.000 | ||||
| Geschlecht | M | W | M | W | M | W | M | W |
| Lymphom | 13 | 31 | 10 | 36 | 4 | 25 | 4 | 44 |
| Lungentumor | 29 | 29 | 43 | 26 | 34 | 31 | 36 | 31 |
| Lebertumor | 4 | 2 | 4 | 2 | 4 | 2 | 2 | 2 |
| Angiom/Angiosarkom | 8 | 4 | 6 | 2 | 2 | 2 | 6 | 8 |
| Haut-/Subkutantumor | 6 | 0 | 14 | 2 | 0 | 4 | 6 | 0 |
| Mammatumor | 0 | 4 | 0 | 2 | 0 | 6 | 0 | 6 |
| Nebennierentumor | 8 | 29 | 0 | 20 | 4 | 21 | 2 | 29 |
| Hardersche Drüse/Tumor | 4 | 4 | 0 | 6 | 2 | 13 | 2 | 8 |
| Sonstige Tumoren | 0 | 4 | 0 | 2 | 0 | 8 | 4 | 6 |
In nur sehr unzureichend dokumentierten chronischen Versuchen an Ratten zeigte Tobiassäure sowohl nach subkutaner Injektion (einmal wöchentlich,1 Jahr; Gesamtdosis 1040-2100 mg/Tier) als auch nach oraler Gabe mit dem Futter (120 mg/Tier an 6 Tagen/Woche, 1 Jahr; Gesamtdosis 33.960 mg/Tier) keine kancerogene Wirkung; die Tumorinzidenzen waren gemäß den Angaben der Autoren mit den in der Veröffentlichung jedoch nichtaufgeführten Kontrollwerten vergleichbar (P > 0,05) (siehe Tabelle 3) (keine näheren Angaben im Literaturzitat) [10].
Tabelle 3: Tumorinzidenzen bei Ratten nach s.c. bzw. oraler Gabe von Tobiassäure über 1 Jahr (nach Ref. [10])
| Dosis/Route | 1040-2100 mg/Tier s.c. | 33.960 mg/Tier oral | ||
| Tumorinzidenzen | absolut | % | absolut | % |
| 2/13 | 15 | 1/10 | 10 | |
Es wurden mit Tobiassäure insgesamt drei verschiedene Kurzzeit-Kancerogenese-Tests durchgeführt.
Im Talgdrüsen-Schwund-Test erhielten 10 männliche Swiss-Mäuse auf die geschorene Rückenhaut an 3 aufeinanderfolgenden Tagen zweimal täglich eine dermale Applikation von je 0,4 mg Tobiassäure in DMSO(Gesamtdosis: 2,4 mg/Tier = ca. 120 mg/kg KGW). Am 4. Tag nach der letzten Applikation wurden die Tiere getötet und die Zahl der Talgdrüsen bestimmt. Tobiassäure bewirkte keine signifikante Verringerung der Zahl der Talgdrüsen pro Haarfollikel [11].
Im Tetrazolium-Reduktions-Test erhielten 10 männliche Swiss-Mäuse auf die geschorene Rückenhaut eine einmalige dermale Applikation von1,7 mg Tobiassäure/Tier = ca. 84 mg/kg KGW) und wurden nach 2 Tagen getötet. An den isolierten Hautarealen wurde dann der Tetrazolium-Reduktions-Test vorgenommen. Tobiassäure führte zu keiner erhöhten Reduktionsrate [12].
Im Implantationstest wurde je 10 männlichen und 10 weiblichen Swiss-Mäusen ein mit 4,5 mg Tobiassäure getränktes Millipore-Filter subkutan implantiert (Dosis ca. 225 mg/kg KGW). Nach 3 Monaten wurden die Tiere getötet und die Implantationsbereiche histopathologisch untersucht. Tobiassäure zeigte auch in diesem Test keine Wirkung [13].
7.4 Genotoxizität
In der Tabelle 4 sind die Ames-Test-Ergebnisse mit Tobiassäure zusammengestellt.
Tabelle 4: Ames-Test-Ergebnisse mit Tobiassäure
| Indikator-Organismus | Dosisbereich (µg/Platte) |
Aktivierung | Ergebnis | Lit. |
| S.typh. TA98, TA100, TA1535, TA1538 | 4 - 2500 | S9 (Ratte) | - | [14] |
| S.typh. TA98, TA100 | ? | mit u. ohne | - | [10] |
| S.typh. TA98 | 5000 | S9 (Ratte, Hamster, Affe, Humanleber) | - | [15] |
| S.typh. TA100 | 5000 | S9 (Ratte) | ? | |
| S.typh. TA100 | 5000 | S9 (Hamster, Affe, Humanleber) | - | |
| S.typh. TA98, TA100 | ? | mit u. ohne | - | [16] |
| S.typh. (Stämme ?) | ? | ? | (+) | [17] |
Im Test an Saccharomyces cerevisiae D4 hatte Tobiassäure weder mit noch ohne Zusatz von S9-Mix eine Erhöhung der mitotischen Genkonversionsrate zur Folge [10].
Im Mikronucleus-Test an der Maus führte die einmalige orale Gabe von 5000 mg/kg KGW zu Vergiftungssymptomen (Apathie, gesträubtes Fell, steifer Gang, Spasmen und orangefarbener Urin), die nach 48 Stunden abklangen; 3 von 40 Tieren starben während des Versuchs. Die Mikronuclei-Rate war gegenüber den Kontrollen nicht erhöht [18].
Im UDS-Test in vitro an Rattenhepatocyten war Tobiassäure im Konzentrationsbereich von 10-300 µg/ml inaktiv [19].
An Mäusen wurde ein Schwesterchromatidaustausch-Test (SCE-Test) durchgeführt. Dazu erhielten die Tiere eine einmalige i.p.-Injektion von 1; 5 bzw. 10 mg/Tier (= ca. 50-500 mg/kg KGW) und wurden anschließend getötet. Im Knochenmark wurde die SCE-Rate bestimmt; sie lag im Bereich der Kontrollen [20].
Mit Tobiassäure wurde auch ein in vitro-Zelltransformationstest an
Humanlungenzellen (WI-38) bzw. Baby Goldhamster Nierenzellen (BHK-21)durchgeführt. Nach Inkubation mit 0,08-250 µg/ml mit und ohne Zusatz von Rattenleber S9-Mix ergaben sich keine Hinweise auf eine zelltransformierende Wirkung [21].
Als Zytotoxizitätstest wurde mit Tobiassäure ein Degranulationstestam rauhen endoplasmatischen Retikulum aus Rattenleberzellen in vitro durchgeführt (Inkubation mit 12 µg/ml für 2 Stunden). Das Ergebnis war negativ [22].
7.5 Reproduktionstoxizität Keine Informationen vorhanden
7.6 Sonstige Wirkungen Keine Informationen vorhanden
8. Bewertende Zusammenfassung der toxikologischen Daten und Ableitung eines Arbeitsplatzrichtwertes (ARW)
Die Einführung der SO3H-Gruppe in ortho-Stellung zur Aminogruppe des β-Naphthylamins hat die2-Amino-1-naphthalinsulfonsäure (Tobiassäure) offensichtlich zu einer akut praktisch untoxischen Verbindung gemacht, die schnell und wohl auch weitestgehend unverändert aus dem Körper wieder ausgeschieden wird. An Haut und Auge wirkt die Substanz nicht reizend, zur Frage der sensibilisierenden Wirkung sowie zur Frage der Reproduktionstoxizität liegen keine Daten vor. Bei diesem einfachen Derivat des β-Naphthylamins stehtindessen die Frage nach einer eventuellen cancerogenen Wirkung im Vordergrund.Die oben erwähnten Metabolismus-Studien an Ratte und Hund weisen auf einen deutlichen Unterschied zum β-Naphthylamin hin.Das wird unterstrichen durch die fehlende mutagene Wirkung in verschiedenen Genotoxizitätstesten sowie durch das Fehlen von Hinweisen auf eine cancerogene Wirkung in Kurzzeit-Testen sowie im chronischen Versuch an der Maus mit hoher oraler Dosierung. Dass die Einführung einer SO3H-Gruppe in ein cancerogenes aromatisches Amin dessen cancerogenes Potential aufhebt oder zumindest stark reduziert, ist für eine Reihe aromatischer Amine nachgewiesen worden, und zwar für Benzidin [23],für Methylorange [24] und für Derivate der Diaminostilbendisulfonsäure [25]. Dies scheint nach den vorliegenden Ergebnissen auch für die 2-Amino-1-naphthalinsulfonsäure(Tobiassäure) zu gelten. Für die reine 2-Amino-1-naphthalinsulfonsäure (Tobiassäure) ist daher nicht mit einem krebserzeugenden Potential zu rechnen.
Für die Ableitung eines Expositionsrichtwertes liegen keine geeigneten Erfahrungen am Menschen vor. In der Cancerogenese-Studie an Mäusen wurde die mit ca. 1500 mg/kg KGW/Tag höchste Dosis bei Verabreichung im Futter offenbar schädigungslos vertragen. Aufgrund des Wirkprofils der Substanz sowie 1unter Einbeziehung eines ausreichenden Sicherheitsabstands und unter Berücksichtigung des Gesichtspunktes der allgemeinen Arbeitsplatzhygiene wird für 2-Amino-1-naphthalinsulfonsäure (Tobiassäure) ein Arbeitsplatzrichtwert (ARW) von 6 mg/m3 mit Spitzenbegrenzung nach Kategorie II,1 festgelegt.
9 Literatur
[1] Marchisio, M.A., Dubini, M., Serra, G., Mennini, T. u. Manara, L.: Br. J. Ind. Med. 33, 269-271 (1976)
[2] Kumar, S., Taylor, G., Hurst, W., Wilson, P. u. Costello, C.B.: Br. J. Ind. Med. 38, 167-169 (1981)
[3] Jamrog, D.: Med. Pracy 10, 1-15 (1959); zitiert in Chem. Abstracts 54, 13.424 f (1960)
[4] Marhold, J.V.: Sbornik Vysledku Toxikologickeho Vysetreni Latek a Pripravku. Prag (1972), Seite 187
[5] Bomhard, E.: Bayer AG, unveröffentlichter Bericht Nr. 17.875 vom 03.04.1989
[6] Bomhard, E.: Bayer AG, unveröffentlichter Bericht Nr. 17.876 vom 03.04.1989
[7] Pauluhn, J.: Bayer AG, unveröffentlichter Bericht Nr. 17.601 vom 11.01.1989
[8] Märtins, T.: Bayer AG, unveröffentlichter Bericht Nr. 17.300 vom 25.10.1988
[9] Della Porta, G. u. Dragani, T.A.: Carcinogenesis 3, 647-649 (1982)
[10] Pogodina, O.N., Svetlova, M.P., Tomilin, N.V., Pliss, G.B. u. Khudolei, V.V.: Eksp. Onkol. 6(4), 23-25 (1984)
[11] Purchase, I.F.H., Longstaff, E., Ashby, J., Styles, J.A., Anderson, D., Lefevre, P.A. u. Westwood, F.R.: Br. J. Cancer 37, 873-903 u. 944-948 (Appendix V: Longstaff, E.) (1978)
[12] Purchase, I.F.H., Longstaff, E., Ashby, J., Styles, J.A., Anderson, D., Lefevre, P.A. u. Westwood, F.R.: Br. J. Cancer 37, 873-903 u. 949-953 (Appendix VI: Westwood, F.R.) (1978)
[13] Purchase, I.F.H., Longstaff, E., Ashby, J., Styles, J.A., Anderson, D., Lefevre, P.A. u. Westwood, F.R.: Br. J. Cancer 37, 873-903 u. 954-959 (Appendix VII: Longstaff, E.) (1978)
[14] Purchase, I.F.H., Longstaff, E., Ashby, J., Styles, J.A., Anderson, D., Lefevre, P.A. u. Westwood, F.R.: Br. J. Cancer 37, 873-903 u. 924-930 (Appendix II: Anderson, D. u. Styles, J.A.) (1978)
[15] Le, J., Jung, R. u. Kramer, M.: Fd. Chem. Toxicol. 23, 695-700 (1985)
[16] Takemura, N. u. Shimizu, H.: Mutation Res. 54, 256-257 (1978)
[17] Japan Chemical Industry Ecology-Toxicology & Information center (JETOC): Newsletter Nr. 4, Seite 19 (1985)
[18] [Herbold, B.A.: Bayer AG, unveröffentlichter Bericht Nr. 17.915 vom 13.04.1989
[19] Lehn, H.: Bayer AG, unveröffentlichter Bericht Nr. 18.502 vom 08.11.1989
[20] Gorecka-Turska, D., Mekler, U. u. Gorski, T.: Bromat. Chem. Toksykol. 15, 37-42 (1983)
[21] Purchase, I.F.H., Longstaff, E., Ashby, J., Styles, J.A., Anderson,D., Lefevre, P.A. u. Westwood, F.R.: Br. J. Cancer 37, 873-903 u. 931-936 (Appendix III: Styles, J.A.) (1978)
[22] Purchase, I.F.H., Longstaff, E., Ashby, J., Styles, J.A., Anderson,D., Lefevre, P.A. u. Westwood, F.R.: Br. J. Cancer 37, 873-903 u. 937-943 (Appendix IV: Lefevre, P.A.) (1978)
[23] Spitz, S., Maguigan, W.H. u. Dobriner, K.: Cancer 3, 789-804 (1950)
[24] Nieper, H.A., Danneberg, P. u. Lo, H.W.: Naturwiss. 43, 500 (1956).
[25] Gloxhuber, C., Hecht, G. u. Kimmerle, G.: Arch. Toxikol. 19, 302-312 (1962)
 |
weiter . |
(Stand: 20.08.2018)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: ab 105.- € netto
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion