a,a'-Dichlormethylbenzol
(45 % 2,5-; 26 % 2,4-; 12 % 3,4-;9 % 2,3-; 6 % 2,6-),
maximal je 2 % Mono- und Trichlortoluole
Luftsättigungskonzentration:
| zurück |
Dichlormethylbenzol (Isomerengemisch, ringsubstituiert)
(CAS-Nr.: 29.797-40-8)
Ausgabe: Januar 2006
Stand: Mai 1994
30 mg/m3 (5 ml/m3) H Spitzenbegrenzung: Kategorie II,1
1 Substanzcharakteristik
| Substanzname: | Dichlortoluol (Isomerengemisch) |
| Synonyma: | a,a'-Dichlortoluol a,a'-Dichlormethylbenzol |
| Zusammensetzung: | mindestens 96 % Dichlortoluole (45 % 2,5-; 26 % 2,4-; 12 % 3,4-;9 % 2,3-; 6 % 2,6-), maximal je 2 % Mono- und Trichlortoluole |
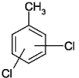
| Strukturformel: |  |
| Summenformel: | C7H6Cl2 |
| CAS-Nummer: | 29.797-40-8 |
| EG-Nummer: | |
| molare Masse: | 161,03 g/mol |
| Schmelzpunkt: | ca. -20°C |
| Siedepunkt: | ca. 201°C |
| Flammpunkt: | ca. 86°C |
| Dampfdruck:
Luftsättigungskonzentration: |
|
| spezifisches Gewicht: | ca. 1,250 g/cm3 (20°C) |
| Löslichkeit: | schwer löslich in Wasser; |
| n-Octanol-Wasser- | löslich in Ethanol, Polyethylenglykol 400 und Propylenglykol |
Verteilungskoeffizient:
| Aussehen: | farblose bis gelbliche Flüssigkeit mit charakteristischem Geruch |
| Umrechnungsfaktoren (20°C): | 1 ml/m3 (ppm) = 6,682 mg/m3
1 mg/m3 = 0,150 ml/m3 (ppm) |
2 Grenzwerte, Einstufungen, Regelungen
2,4-Dichlortoluol: MAK (UdSSR) 10 mg/m3 H (2,4-Dichlortoluol-Gehalt im Gemisch: ca. 26 %)
VbF: Klasse a III Transportregelungen:
| GGVE/GGVS: | Kl. 3 Zi. 32 C |
| RID/ADR: | Kl. 3 Zi. 32 C |
| ADNR: | Kl. 3 Zi. 4 |
3 Herstellung und Verwendung
Dichlortoluole entstehen neben Monochlortoluolen bei der Chlorierung von Toluol.
Dichlortoluol-Isomerengemisch wird als Lösungsmittel verwendet und dient außerdem als Zwischenprodukt bei chemischen Synthesen.
4 Analytische Bestimmungsmethode
| Probenahme: | Adsorption an Aktivkohle SKC 700/300 mg |
| Pumpe: | Compur 4903 (0,06 l/min, ca. 3,6 l in einer Stunde) |
| Desorption: | 3 ml Schwefelkohlenstoff 30 min bei Raumtemperatur stehen lassen Gaschromatographische |
| Bestimmung: | Injektionsvolumen 2 µl Kapillarsäule 30 m, DB-5 Ofentemperatur 70°C isotherm FID |
| Kalibrierung: | externer Standard |
| Bestimmungsgrenze: | 1 mg/m3 bei 30 l Probeluft |
5 Metabolismus, Toxikokinetik
Beim Hund kommt es nach oraler Gabe von Dichlortoluol zu keiner Merkaptursäure-Bildung [1].
6 Erfahrungen am Menschen
Keine Informationen vorhanden
7. Experimentelle Toxizitätsdaten
7.1 Akute Toxizität, lokale Verträglichkeit, Sensibilisierung
7.1.1 Akute Toxizität
Die Daten zur akuten Toxizität von Dichlortoluol sind in der Tabelle 1 zusammengestellt.
Nach akuter oraler Gabe von Dichlortoluol wurde bei Ratten ab einer Dosis von 2500 mg/kg KGW vermehrter Speichelfluss, Sedation, gesträubtes Fell, Seitenlage, Nasenausfluss sowie vereinzelt eine blutige Schnauze festgestellt; die Dosis von 1000 mg/kg KGW wurde von allen Tieren symptomlos vertragen [2].
Tabelle 1: Daten zur akuten Toxizität von Dichlortoluol
| Spezies | Geschl. | Applikationsweg | LD50/LC50 | Ref. |
| Ratte | männl. | oral | 3179 mg/kg KGW | [2] |
| Ratte | weibl. | oral | 2344 mg/kg KGW | [2] |
| Ratte | mnl./wbl. | oral | 2438 mg/kg KGW* | [3] |
| Ratte | männl. | oral | 2723 mg/kg KGW | [4] |
| Ratte | mnl./wbl. | oral | > 2000 mg/kg KGW** | [5] |
| Ratte | mnl./wbl. | dermal | > 2000 mg/kg KGW° | [6] |
| Ratte | mnl./wbl. | dermal | > 2000 mg/kg KGW** | [7] |
| Ratte | mnl./wbl. | inhalativ | > 2669 mg/m3/4 h*** | [8] |
*) Mono-Dichlortoluol-Gemisch
**) 2,6-Dichlortoluol roh (36,3 % 2,6-; 40,3 % 2,5- und 22,2 % 2,4-Dichlortoluol); symptomlos vertragen
***) 2,4-Dichlortoluol (rein); symptomlos vertragen
°) keine Todesfälle
Die akute dermale Applikation von 2000 mg Dichlortoluol/kg KGW führte bei Ratten lediglich zu Lautäußerungen; systemische Effekte oder Todesfälle traten nicht auf und die bei Versuchsende getöteten Tiere waren pathologisch-anatomisch unauffällig [6].
Es wurde ein Zeitsättigungstest an Ratten durchgeführt. Dazu wurden je 5 männliche und 5 weibliche Tiere einer bei 20°C, 30°Cbzw. 95°C gesättigten Dichlortoluol-Dampfatmosphäre Ganzkörperexponiert (dynamische Verdampfung). Die Expositionszeit betrug jeweils 7 Stunden (im Test bei 95°C auch 3 Stunden), gefolgt von einer14-tägigen Nachbeobachtungszeit. Bei 20°C und bei 30°C traten keine Todesfälle auf. Die Tiere zeigten Unruhe, Atmungsbeschwerden, Schleimhautreizungen und zeitweise Sedation; die Symptome klangen spätestens nach 12 Tagen ab. Bei 95°C starb bei 3-stündiger Exposition 1 von 5 Weibchen und bei 7-stündiger Exposition starben 2 Männchen und 1 Weibchen. Es traten die gleichen Vergiftungssymptome wie in den anderen Versuchsgruppen und zusätzlich Erregungszustände auf und persistierten bis zum Tod der Tiere. Bei der Sektion der verendeten Tiere (95 °C, 7 Std.) wurden emphysematös veränderte Lungen, fleckige Leber und Reizungen der Drüsenmagenschleimhaut (bedingt durch orale Aufnahme beim Reinigen des Fells) festgestellt. Die Sektion der Ende der Nachbeobachtungszeit getöteten Tiere blieb ohne Befund [9].
7.1.2 Lokale Verträglichkeit
Das Dichlortoluol-Gemisch wirkt leicht bis mäßig reizend an der Kaninchenhaut und leicht reizend am Kaninchenauge [9,10].
Das Mono-Dichlortoluol-Gemisch wirkt mäßig reizend an der Haut (24 Stunden okklusiv) [11] und nicht reizend am Auge von Kaninchen [12].
7.1.3 Sensibilisierung
Im Maximierungstest nach Magnusson und Kligmann zeigte das Dichlortoluol-Gemisch nach intradermaler (5 %ig) und topischer Induktion (100 %ig) und Provokation (25 und 50 %ig) bei Meerschweinchen keine hautsensibilisierende Wirkung [13].
7.2 Subakute, subchronische Toxizität
Es wurde eine subakute orale Toxizitätsstudie mit dem Dichlortoluol-Isomerengemisch an Ratten durchgeführt. Dabei erhielten je 5 männliche und 5 weibliche Ratten/Dosisgruppe über einen Zeitraum von 4 Wochen an 5 Tagen/Woche orale Gaben von 0; 20; 100 bzw. 500 mg Dichlortoluol/kg KGW/Tag mit der Magensonde verabreicht. Die Behandlung wurde bis zu einer Dosis von 100 mg/kg KGW/Tag schädigungslos vertragen, wobei der1 ab 20 mg/kg KGW/Tag auftretenden hyalintropfigen Speicherung in den Tubulusepithelien der männlichen Tiere als spezies- und geschlechtsspezifischem Effekt keine Bedeutung für die Risikoabschätzung für den Menschen beigemessen wird (vgl. MAK-Begründung zu
p-Dichlorbenzol). Bei allen Tieren der 500 mg/kg-Gruppe waren die Lebergewichte erhöht als Ausdruck einer Stoffwechseladaptation. Bei den Männchen dieser Dosisgruppe lag eine Hypertrophie zentrilobulärer Hepatozytenvor und außerdem waren als Folge der Hyalintröpfchenbildung in der Niere fokal meist leicht erweiterte Tubulusabschnitte vorhanden. Die Weibchen der 500 mg/kg-Gruppe zeigten eine leicht erhöhte Wasseraufnahme. Schädigungen des Gehirns oder anderer Organe wurden nicht festgestellt.Aussehen und Verhalten sowie die Körpergewichtsentwicklung und die Futteraufnahme blieben in allen Dosisgruppen unbeeinflusst, Todesfälle traten nicht auf.
Damit ergibt sich in dieser Studie für die Männchen ein NOAEL von 100 mg/kg und für die Weibchen ein NOAEL von 500 mg/kg KGW/Tag [14].
In einer aufgrund unzureichender Angaben nur bedingt bewertbaren Publikation wird berichtet, dass die 20-tägige orale Gabe von 920 mg2,4-Dichlortoluol/kg KGW/Tag (=1/5 LD50) bei Ratten (keine Angaben zu Anzahlund Geschlecht der Tiere) zu keinen Todesfällen führte. Die orale Gabe von 4600 mg/kg KGW (=LD50) über den gleichen Zeitraum bewirkte eine 80 %ige Mortalität (keine näheren Angaben) [15].
Im Rahmen einer ebenfalls nur sehr unvollständig dokumentierten subchronischen Toxizitätsstudie erhielten Ratten über einen Zeitraum von 2 Monaten tägliche orale Gaben von 4,6; 46 bzw. 460 mg2,4-Dichlortoluol/kg KGW. Bei den Tieren der 460 mg/kg-Gruppe kam es zu V1eränderungen der für den funktionellen Zustand von Leber, Nieren und Zentralnervensystem charakteristischen Parameter. Bei der histopathologischen Untersuchung der Tiere wurden Veränderungen vorwiegend an Leber und Nieren, in geringerem Ausmaß auch am Zentralhirn festgestellt. Beiden Tieren der 46 mg/kg-Gruppe wurden die gleichen Effekte in geringerer Ausprägung beobachtet. Die Dosis von 4,6 mg/kg KGW/Tag wurde symptomlos vertragen. Aufgrund der fehlenden Angaben zum Versuchsaufbau sowie wegen der nur sehr pauschalen Darstellung der Befunde ist diese Studie nicht bewertbar [15].
7.3 Chronische Toxizität, Cancerogenität
Keine Informationen vorhanden
7.4 Genotoxizität
Im Ames-Test an den Salmonella typhimurium-Stämmen Ta 98, Ta 100, TA1535 und Ta 1537 zeigte das Dichlortoluol-Gemisch im Konzentrationsbereichvon 8 - 5000 µg/Platte sowohl mit als auch ohne Zusatz von Rattenleber-S9-Mix keine mutagene Wirkung [16].
2,4-Dichlortoluol zeigte im Ames-Test mit und ohne Zusatz von S9-Mix keine mutagene Wirkung [17].
Ebenfalls negativ war ein Ames-Test an 2,6-Dichlortoluol roh (Hauptkomponenten:36,3 % 2,6- + 40,3 % 2,5- und 22,2 % 2,4-Dichlortoluol) sowohl mit als auch ohne Zusatz von S9-Mix [18].
In Studien an trächtigen Ratten führte die orale Gabe von 920 bzw.92 mg 2,4-Dichlortoluol/kg KGW (= 1/5 bzw. 1/50 LD50) zu einer erhöhten Chromosomenaberrationsrate in somatischen Zellen; der NOEL lag bei 46 mg/kg KGW.
Die Behandlung von männlichen Ratten mit 46 mg 2,4-Dichlortoluol/ kg KGW führte nach der Paarung mit unbehandelten Weibchen zu einer erhöhten Rate an Postimplantationsverlusten, was auf eine mutagene Wirkung der Substanz in vivo hinweist (dominante letale Mutationen). Als NOEL ergab sich 4,6 mg/kg KGW (= 1/1000 LD50). Aufgrund des unklaren Versuchsaufbaus und der völlig unzureichend dokumentierten Befunde sind diese Studien nicht bewertbar [15].
Im Mikronucleus-Test an der Maus führte die einmalige i.p.-Injektion von 1500 mg Dichlortoluol-Gemisch/kg KGW zu toxischen Effekten; Todesfälle traten nicht auf. Es ergaben sich keine Hinweise auf eine clastogene Wirkung des Prüfmusters (Aufarbeitung des Knochenmarks 16, 24 und 48 Stunden nach der Applikation) [19].
7.5 Reproduktionstoxizität
Die Ergebnisse der subakuten oralen Studie mit Dichlortoluol-Gemisch an Ratten [14] erbrachten keine Hinweise auf reproduktionstoxikologisch relevante Effekte.
Die orale Gabe von 92 bzw. 920 mg 2,4-Dichlortoluol/kg KGW/Tag (keine Angaben zu Versuchsaufbau und -dauer) führte bei trächtigen Ratten zumTod der Embryonen im postimplantalen Entwicklungsstadium sowie zu V1erzögerungen im Wachstum der Feten und der Plazenta. Außerdem war die Fertilität der Tiere der 920 mg/kg-Gruppe reduziert; teratogene Effekte traten nicht auf. Als NOEL für die embryotoxische Wirkung wurde die Dosis von 9,2 mg/kg KGW angegeben. Aufgrund der völlig unzureichenden Darstellung des Versuchsaufbaus und der Befunde ist diese Studie nicht bewertbar [15].
Bei männlichen Ratten, die über einen Zeitraum von 2 Monaten tägliche orale Gaben von 46 bzw. 460 mg 2,4-Dichlortoluol/kg KGW erhalten hatten, wurden Anzeichen für Schädigungen der Gonaden (morphologische Veränderungen, verringerte Spermatogenese) festgestellt. Außerdem kam es bei den Tieren der 460 mg/kg-Gruppe zu pathologisch veränderten Spermien. Die Dosis von 4,6 mg/kg wurde schädigungslos vertragen. Aufgrund der völlig unzureichenden Darstellung des Versuchsaufbaus und der Befunde ist diese Studie nicht bewertbar [15].
7.6 Sonstige Wirkungen
Keine Informationen vorhanden
8. Bewertende Zusammenfassung der toxikologischen Daten und Ableitung eines Arbeitsplatzrichtwertes (ARW)
Das Dichlortoluol-Gemisch zeigt nach akuter Gabe (oral, dermal, inhalativ)nur eine sehr geringe Toxizität, wirkt leicht bis mäßig reizendan Haut und Auge und besitzt im Tierversuch an Meerschweinchen kein hautsensibilisierendes Potential. Im Inhalationsrisiko-Test an Ratten mit einer bei 95°C gesättigten Dampfatmosphäre kam es nach7-stündiger Exposition zu Todesfällen; die Sektion ergab Hinweise auf leichte Schädigungen von Lunge und Leber.
Zur Frage der Toxizität des Dichlortoluol-Gemischs nach wiederholter Applikation liegen die Ergebnisse einer Studie zur subakuten oralen Toxizität an Ratten vor. Demnach liegt der NOAEL für die männlichen Tiere bei 100 mg/kg KGW/Tag; bei höherer Dosierung kommtes bei den Männchen zu einer leichten Hypertrophie der läppchenzentralen Hepatozyten sowie zu Nierenveränderungen als Folge der Hyalintröpfchenbildung, die sich bereits in der 20 mg/kg-Gruppe manifestiert und als spezies- und geschlechtsspezifisches Phänomen anzusehen ist. Bei den Weibchen liegt der NOAEL in dieser Studie bei 500 mg/kg KGW/Tag.
Im Ames-Test ist das Dichlortoluol-Gemisch und auch das reine 2,4-Dichlortoluolnicht mutagen und im Mikronucleus-Test an der Maus zeigt das Dichlortoluol-Gemisch keine clastogene Wirkung.
In der subakuten Studie an Ratten ergaben sich keine Hinweise auf reproduktionstoxikologisch relevante Effekte. Die in einer Publikation berichteten Effekte nach oraler Behandlung mit 2,4-Dichlortoluol bleiben aufgrund der mangelnden Validität der Studie unberücksichtigt.
Für die Ableitung eines Richtwertes können lediglich die Ergebnisse der subakuten oralen Toxizitätsstudie an Ratten herangezogen werden,wonach der niedrigste (für den Menschen relevante) NOAEL bei 100 mg/kgKGW/Tag liegt. Ausgehend von diesem NOAEL im subakuten Versuch (ca. 25mg/Tier/Tag) wird unter Anwendung eines Faktors von 1/6 ein NOEL für die 1chronische Exposition von ca. 4,2 mg/Tier/Tag extrapoliert. Unter Berücksichtigung des Allometrieprinzips (x 68) und bei Zugrundelegungeines Atemvolumens von 10 m3/Tag ergibt sich damit ein Richtwert von ca. 29 mg/m3. Dementsprechend wird für das Dichlortoluol-Gemisch ein Arbeitsplatzrichtwert (ARW) von 5 ppm = 30mg/m3 mit Spitzenbegrenzung nach Kategorie II,1 und dem Zusatz H empfohlen. Dieser Richtwert wird als ausreichend angesehen, um den Schutz der Exponierten vor möglichen lebertoxischen Effekten des Dichlortoluol-Isomerengemischs zu gewährleisten.
9 Literatur
[1] Baumann, E.: Zeitschr. physiol. Chem. 8, 190-197 (1883)
[2] Bomhard, E.: Bayer AG, unveröffentlichter Bericht Nr. 15.630 vom 11.03.1987
[3] Löser, E.: Bayer AG, unveröffentlichter Bericht vom 26.11.1980
[4] Bomhard, E.: Bayer AG, unveröffentlichter Bericht vom 29.01.1979
[5] Bomhard, E.: Bayer AG, unveröffentlichter Bericht Nr. 18.249 vom 09.08.1989
[6] Bomhard, E.: Bayer AG, unveröffentlichter Bericht Nr. 21.337 vom 05.05.1992
[7] Bomhard, E.: Bayer AG, unveröffentlichter Bericht Nr. 18.255 vom 10.08.1989
[8] Pauluhn, J.: Bayer AG, unveröffentlichter Bericht Nr. 18.515 vom 13.11.1989
[9] Thyssen, J.: Bayer AG, unveröffentlichter Bericht Nr. 8555 vom 07.08.1979
[10] Ruf, J.: Bayer AG, unveröffentlichter Bericht Nr. 15.462 vom 22.01.1987
[11] Schreiber, G.: Fraunhofer-Institut für Toxikologie und Aerosolforschung, unveröffentlichter Bericht vom 30.06.1981 an die Bayer AG
[12] Schreiber, G.: Fraunhofer-Institut für Toxikologie und Aerosolforschung, unveröffentlichter Bericht vom 30.06.1981 an die Bayer AG
[13] Dreist, M. u. Kolb, J.: Bayer AG, unveröffentlichter Bericht Nr. 21.470 vom 01.07.1992
[14] Bomhard, E. u. Rühl-Fehlert, C.: Bayer AG, unveröffentlichter Bericht Nr. 22.273 vom 25.05.1993
[15] Tolstopyatova, G.V., Korkach, V.I., Barilyak, I.R., Samoilov, A.P., Gudz, O.V. u. Bychkovskii, B.N.: Gig. Sanit. Nr. 2, 80-81 (1988)
[16] Gahlmann, R.: Bayer AG, unveröffentlichter Bericht Nr. 20.999 vom 22.01.1992
[17] Herbold, B.A.: Bayer AG, unveröffentlichter Bericht Nr. 18.017 vom 19.05.1989
[18] Herbold, B.A.: Bayer AG, unveröffentlichter Bericht Nr. 18.140 a vom 20.12.1991
[19] Herbold, B.A.: Bayer AG, unveröffentlichter Bericht Nr. 21.996 vom 21.01.1993
 |
weiter . |
(Stand: 20.08.2018)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: 90.- € netto (Grundlizenz)
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion