2-Hydroxyethoxyethylazanorbornan
EPS-7305
149 °C bei 2,1 kPa
101 Pa (50°C)
| zurück |
2-(2-(2-Hydroxyethoxy)-ethyl)-2-azabicyclo[2.2.1]heptan
(2-(Hydroxyethoxyethyl)-2-azabicyclo[2.2.1]heptan)
(CAS-Nr.: 116230-20-7)
Ausgabe: Januar 2006
Stand: 21.03.2005
5 mg/m3
0,5 ml/m3
Stoffcharakterisierung
| Synonyme: | Thancat AN 20 2-Hydroxyethoxyethylazanorbornan EPS-7305 |
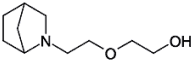
| Strukturformel: |  |
| Summenformel: | C10H19NO2 |
| Molekulargewicht: | 185,30 g/Mol |
| CAS-Nr.: | 116.230-20-7 |
| Schmelzpunkt: | -69,2 C |
| Siedepunkt: | 104 °C bei 0,05 kPa
149 °C bei 2,1 kPa |
| Dampfdruck: | 46 Pa (30°C)
101 Pa (50°C) |
| Hydrolysegeschwindigkeit: | nicht hydrolyse empfindlich |
| Wasserlöslichkeit: | 1000 g/l (20°C) |
| Fettlöslichkeit | 1000 mg/100g (37 °C) |
| Verteilungskoeffizient: (log Po/w) | 2,0 (20 °C) |
Allgemeiner Wirkcharakter
Die Wirkung von 2-(Hydroxyethoxyethyl)-2-azabicyclo[2.2.1]heptan wird durch seinen alkalischen Charakter maßgeblich bestimmt. In der akuten oralen, dermalen und inhalativen Studie, im Hautreiztest sowie im subakuten Fütterungsversuch und im 2- und 13-Wochen-Inhalationsversuch sind dosisabhängig in ihrem Schweregrad zunehmende, z. T. massive Veränderungen der direkt belasteten Gewebe beschrieben worden. Bei Aufnahme über den Magen-Darm-Trakt treten Todesfälle im akuten Versuch deutlich schneller nach Schlundsondenapplikation ein, als nach Gabe über das Futter. Die gute Wasserlöslichkeit des Stoffes führt bei inhalativer Aufnahme dazu, dass Veränderungen vorrangig im oberen Atemtrakt auftreten.
2-(Hydroxyethoxyethyl)-2-azabicyclo[2.2.1]heptan hat keine hautsensibilisierenden oder mutagenen Eigenschaften gezeigt.
Erfahrungen am Menschen
Erfahrungen am Menschen liegen nach den bisher eingereichten Unterlagen nicht vor.
Tierexperimentelle Befunde
Akute Toxizität
Orale Aufnahme
Männlichen und weiblichen Wistar Ratten, je 5 Tiere pro Versuchsgruppe und Geschlecht wurde 2-(Hydroxyethoxyethyl)-2-azabicyclo[2.2.1]heptan unverdünnt in Dosierungen von 104; 312; 585 & 1040 mg/kg mittels Schlundsonde einmalig verabreicht (Hapke & Kietzmann, 1987a).
Erste Todesfälle traten bei 585 mg/kg auf. Die verstorbenen Tiere zeigten vor dem Exitus Streckkrämpfe; bei der anschließenden Sektion wurde eine lokal begrenzte blutige Durchtränkung der Magenschleimhaut beschrieben.Alle vorzeitigen Todesfälle traten innerhalb von 24 Stunden auf. Die LD50 Angaben finden sich in Tabelle 1.
Ein weiterer Versuch zur akut oralen Toxizität wurde an je 3Sprague-Dawley-Ratten pro Dosis und Geschlecht mit einmaligen Dosierungenvon 105; 226; 332; 487 & 715 mg/kg KGW durchgeführt (Leuschner etal., 1990a). Zusätzlich wurden weibliche Tiere analog mit 1050 und 1544mg/kg KGW behandelt. Die Applikation der Substanz erfolgte als Lösung in Wasser mittels Schlundsonde.
Dosierungen bis zu 226 mg/kg bei den männlichen Tieren und 487 mg/kg bei den weiblichen Tieren wurden ohne Todesfälle vertragen. Oberhalb dieser Dosierungen stieg die Mortalität dosisabhängig an. Die Todesfälle traten in allen Fällen während der ersten 24 Stunden nach Gabe der Substanz auf. In der höchsten Dosierung der Weibchen verstarben die Tiere bereits nach einer Stunde. Während der Beobachtungszeit reagierten die Versuchstiere mit reduzierter Bewegung, Ataxie, Dyspnoe, reduziertem Muskeltonus und Tremor. Die Angaben zur LD50 finden sich in Tabelle 1.
Im Vorversuch zur subakuten oralen Untersuchung wurden je 2 männliche und weibliche Sprague-Dawley-Ratten täglich mit 1040; 5200 & 10.400mg/kg per Schlundsonde behandelt (Leuschner et al, 1991). Die Tiere der höchsten Dosierung verstarben 20 Minuten; die Tiere der mittleren Dosierungen 30 Minuten nach Gabe der ersten Dosis. Die Gabe von 1040 mg/kg wurde zunächst überlebt; diese Tiere starben nach der zweiten Dosierung.
Als Vorversuch zum Mikronukleustest an CD-1-Mäusen wurde2-(Hydroxyethoxyethyl)-2-azabicyclo[2.2.1]heptan als wässrige Lösungmittels Schlundsonde an Gruppen von 3 Tieren pro Geschlecht in Dosierungen von 141; 202; 288; 412; 588; 840; 1200 & 1714 mg/kg Körpergewicht verabreicht (McEnaney, 1990); die Tiere wurden nach Substanzgabe lediglich3 Tage beobachtet. Dosierungen bis zu 202 mg/kg bei den Weibchen und 412mg/kg bei den Männchen wurden ohne Mortalität vertragen. Aus den Mortalitätsdaten kann die LD50 zu ca. 330 mg/kg (9) bzw.580 mg/kg (d) abgeschätzt werden (s. Tabelle 1). Vergiftungserscheinungen wurden von den Autoren nicht beschrieben.
Dermale Aufnahme
Ein dermaler akuter Toxizitätsversuch mit einmaligen Dosierungen von520; 780; 880; 990 sowie 1040 mg/kg für männliche und 520; 1040und 2080 mg/kg für weibliche Wistar-Ratten ergab die in Tabelle 1dargestellten Letalitätsdaten. Die Substanz wurde unverdünnt unternichtokklusiven Bedingungen auf die geschorene Rückenhaut der Tiere aufgebracht; ein Ablecken der Prüfsubstanz wurde durch Haltung der Tierein engen Käfigen verhindert. Erste Todesfälle traten bei denmännlichen Tieren bei 880 mg/kg und bei den weiblichen Tieren bei 1040mg/kg auf und nahmen mit steigender Dosierung streng dosisabhängig zu.Der Tod trat bei allen verstorbenen Tieren innerhalb der ersten 6 Stundenein; alle Tiere zeigten vor dem Exitus Streckkrämpfe. Die nicht verstorbenen Tiere reagierten auf die Substanzgabe mit apathischem Verhalten während der ersten 24 Stunden. (Hapke & Kietzmann, 1987b).
Inhalative Aufnahme
In einem akuten Inhalationsversuch wurden je 3 männliche und weibliche Sprague-Dawley-Ratten pro Dosierung (3500; 5600 & 6600 mg/m3)einmalig gegen 2-(Hydroxyethoxyethyl)-2-azabicyclo[2.2.1]heptan oronasal über 4 Stunden exponiert (Leuschner et al., 1990b). Das generierte Aerosol wies einen aerodynamischen Durchmesser von etwa 1,2 µm auf. Keines der exponierten Tiere verstarb während der Versuchsdurchführung; sie reagierten auf die Belastung mit reduzierter Bewegung, Ataxie, Dyspnoe, reduziertem Muskeltonus. Weibchen zeigten darüber hinaus reduzierte Körpergewichtsentwicklung, Tremor und Ptosis. Makroskopisch konnten nach einer 14-tägigen expositionsfreien Zeit keine Veränderungen festgestellt werden, so dass keine histopathologische Untersuchung durchgeführt wurde.
Tabelle 1: Angaben zur akuten Letalität von 2-(Hydroxyethoxyethyl)-2-azabicyclo[2.2.1]heptan
| Aufnahmeweg | Spezies | Stamm | Geschlecht | LD50 / LC50 | Literatur | |
| Schlundsonde, in Trinkwasser | Ratte | Sprague-Dawley |  |
872 | mg/kg | Leuschner et al., 1990a |
 |
452 | |||||
| Schlundsonde, unverdünnt | Ratte | Wistar |  |
720 | mg/kg | Hapke/Kietzmann, 1987a |
 |
950 | |||||
| Schlundsonde, in Trinkwasser | Maus | CD-1 |  |
ca. 330 | mg/kg | McEnanay, 1990 |
 |
ca. 580 | |||||
| dermal, unverdünnt | Ratte | Wistar |  |
1140 | mg/kg | Hapke/Kietzmann, 1987b |
 |
940 | |||||
| inhalativ, Aerosol | Ratte | Sprague-Dawley |  |
> 6600 | mg/m3 (4h) | Leuschner et al., 1990b |
Subakute und subchronische Toxizität
Folgende Studien mit wiederholter Verabreichung liegen für 2-(Hydroxyethoxyethyl)-2-azabicyclo[2.2.1]heptan vor:
Tabelle 2: Übersicht über die Dosierungen / Konzentrationen und die Zielorgane der Studien.
| Studiendauer / Applikationsweg | NOAEL | Dosierungen / Luftkonzentrationen und Zielorgane | |||
|
o r a l |
7 Tage / Schlundsonde | 1040mg/kg | 5200 mg/kg | 10.400 mg/kg | |
| vollständige Mortalität innerhalb 1-2 Tagen | |||||
| 7 Tage / Fütterung | 104 mg/kg | 1040mg/kg | 5200 mg/kg | 10.400 mg/kg | |
| Piloarrektion | vollst. Mortalität innerhalb 5-7 Tagen | ||||
| 28 Tage / Fütterung | 105 mg/kg, 315 mg/kg |
945 mg/kg | |||
| Niere, Leber, Pankreas, Hoden, Harnleiter & Harnblase | |||||
| i n h a l a t i v |
14 Tage / Dampf & Aerosol | 11 mg/m3 | 44 mg/m3 | 191 mg/m3 | 1019 mg/m3 (4Tage) |
| Nasenpassage | Nasenpassage, Trachea, Larynx, Lunge | Nasenpassage, Trachea, Larynx, Lunge | |||
| 90 Tage / Dampf & Aerosol | 10 mg/m3 | 60 mg/m3 | 153 mg/m3 | ||
| Nasenpassage | Nasenpassage, Nasopharynx, Larynx, Trachea, Lunge | Nasenpassage, Nasopharynx, Larynx, Trachea, Lunge, Ovarien | |||
Orale Aufnahme
Im Vorversuch zur subakuten oralen Untersuchung wurden je 2 männliche und weibliche Sprague-Dawley-Ratten täglich mit 1040; 5200 und 10.400mg/kg per Schlundsonde behandelt (Leuschner et al, 1991). Die Tiere der höchsten und der mittleren Dosierung verstarben unmittelbar nach Gabe der ersten Dosis. Die Gabe von 1040 mg/kg wurde zunächst überlebt; diese Tiere starben nach der zweiten Dosierung.
In einem Parallelversuch mit Gabe der identischen Dosen (1040; 5200 und 10.400mg/kg Körpergewicht) über das Futter wurde je 2 Sprague-Dawley-Rattenpro Dosis und Geschlecht über 7 Tage sowie zusätzlich 2männlichen und einem weiblichen Tier 104 mg/kg Körpergewicht über14 Tage verabreicht. Die Gabe von 104 mg/kg wurde von allen Tieren über die gesamte Versuchsdauer ohne Beeinträchtigungen vertragen. Die Tiere der 1040 mg/kg Gruppe reagierten auf die Applikation mit geringfügig erhöhter Futteraufnahme, Körpergewichtszunahme und Piloarrektion.Kein Tier dieser Gruppe verstarb in der Behandlungszeit. Die Ratten der 5200und 10.400 mg/kg Gruppen zeigten reduzierte Futteraufnahme, reduzierte Körpergewichte und zerzaustes Fell; die Effekte waren in der höheren Dosierung ausgeprägter. Mit Ausnahme eines Weibchens der 10.400 mg/kg Gruppe verstarben alle Tiere innerhalb von 5 bis 7 Tagen. Aus diesen Ergebnissen leiteten die Autoren ab, dass 2-(Hydroxyethoxyethyl)-2-azabicyclo[2.2.1]heptan bei Applikation im Futter besser vertragen wird als mittels Schlundsondenapplikation.
Aufgrund dieser Vorversuche erhielten je 5 männliche und weibliche Sprague-Dawley-Ratten 0; 105; 315 und 945 mg/kg Körpergewicht an 7 Tagen pro Woche über 4 Wochen im Futter verabreicht (Leuschner et al., 1991).Je 5 zusätzliche männliche und weibliche Tiere wurden analog mit945 mg/kg dosiert und nach Ende der Belastung weitere 4 Wochen nachbeobachtet (Recoverygruppe).
Die beiden unteren Dosierungen wurden von allen Tieren symptomlos vertragen;der NOAEL dieser Studie ist daher 315 mg/kg. In der höchsten Dosis verstarb ein männliches Tier am 19. Tag. Alle Ratten der höchsten Dosisgruppewurden ab der zweiten Versuchswoche als unruhig und schreckhaft beschrieben; sie zeigten zusätzlich Piloarrektion. Das Körpergewicht dermännlichen Tiere war um 20 bis 40 % reduziert, das der weiblichen Tiereum 11 bis 20 %. Verbunden mit dieser Reduktion der Körpergewichte waren leicht, aber signifikant reduzierte absolute Organgewichte in Herz, Lunge,Milz und Thymus, bei den Weibchen im Uterus beschrieben. Histopathologische Veränderungen wurden nicht beobachtet. Die weiteren Befunde sind in Tabelle 3 dargestellt.
Tabelle 3: Ergebnisse der subakuten oralen Untersuchung an Sprague-Dawley-Ratten (Leuschner et al., 1991)
| Geschlecht | Dosis [mg/kg] |
Effekt | |||||||||||||||||
 |
0 | ohne Befund | |||||||||||||||||
| 105 | keine substanzbedingten Effekte | ||||||||||||||||||
| 315 | NOAEL | ||||||||||||||||||
| 945 | Mortalität (1/5) am 19. Tag; Kongestion in Leber, Milz und Nieren sowie
Tubulopathie Reduktion des Körpergewichtes um 20-40% Herz- (abs.), Lungen- (abs.), Milz- (abs.) und Thymusgewicht (abs. & rel.) erniedrigt.
|
||||||||||||||||||
| 945 Recovery |
|
||||||||||||||||||
 |
0 | ohne Befund | |||||||||||||||||
| 105 | keine substanzbedingten Effekte | ||||||||||||||||||
| 315 | NOAEL | ||||||||||||||||||
| 945 | keine Organeffekte, Reduktion des Körpergewichtes 11-20% abs. & rel. Ovariengewicht reduziert | ||||||||||||||||||
| 945 Recovery |
|
Inhalative Aufnahme
In einer zweiwöchigen Vorstudie (Coombs et al., 1995a) wurden 5Sprague-Dawley-Ratten pro Konzentration und Geschlecht in einer Ganzkörperexposition an 6 Stunden pro Tag und 5 Tage die Woche gegen11 (Dampf); 44 (Dampf); 191 (Aerosol) und 1019 (Aerosol) mg/m32-(Hydroxyethoxyethyl)-2-azabicyclo[2.2.1]heptan exponiert. Der mittlereaerodynamische Durchmesser (MMAD) wurde zu 2,2 µm bestimmt. Die Exposition gegen die höchste Luftkonzentration musste nach 4 Tagen beendet werden.
Die Tiere der niedrigsten Konzentration zeigten keinerlei Veränderung, so dass diese Luftkonzentration (11 mg/m3) den NOAEL darstellt.
In den oberen drei Konzentrationen reagierten die Tiere mit geschlossenen Augen, Speichelfluss, Niesen und Schnappen nach Luft. Die Tiere der höchsten Konzentration zeigten darüber hinaus deutliche Körpergewichtsverluste in Verbindung mit einer ausgeprägten Reduktionen in Wasser- und Futterverbrauch.
In der 44 mg/m3 Gruppe zeigten die Tiere Hyperplasie des respiratorischen Epithels und des Übergangsepithels sowie Hyperplasie der Becherzellen in der Nase. Mit steigender Luftkonzentration steigerten sich die Befunde in der Nasenhöhle hinsichtlich Schweregrad und Inzidenz. Zusätzlich traten bei 191 und 1019 mg/m3
Hyperplasien am Larynx (bei 1019 mg/m3 zusätzlich Metaplasien am Larynx) sowie Entzündungen, Fibrosen und Becherzellhyperplasie in der Lunge auf. Die Befunde sind in Tabelle 4a (d) und Tabelle 4b (9) detailliert beschrieben.
Aufbauend auf die zweiwöchige Inhalationsstudie wurden je 10Sprague-Dawley-Ratten pro Konzentration und Geschlecht über 13 Wochen,6 Stunden pro Tag, 5 Tage pro Woche in Konzentrationen 10 (Dampf); 60 (Dampf)und 153 mg/m3 (Dampf und Aerosole) in einer Ganzkörperexposition exponiert (Coombs et al., 1995b). In der Luftkontrolle sowie in der höchsten Konzentration (153 mg/m3) wurden zusätzlich pro Geschlecht 10 Tiere in analoger Weise exponiert und nach Ende der Exposition in einer 4-wöchigen Periode nachbeobachtet (Recovery).
Während der Exposition zeigten die Tiere der höchsten Konzentration geschlossene Augen, Lecken des Maulinneren, forcierte Atmung und Reiben der Schnauze mit den Vorderpfoten. Außerhalb der Expositionsintervalle wurde bei diesen Tieren eine geräuschvolle Atmung beschrieben. Die Futteraufnahme und als Folge die Körpergewichtsentwicklung dieser Tiere war reduziert. Des Weiteren waren die tracheobronchealen Lymphknoten dieser Tiere sowie eines Tieres der mittleren Konzentration vergrößert.Die Lungengewichte der Tiere waren im Vergleich zu den Kontrollen sowohl nach Expositionsende als auch am Ende der Nachbeobachtungsphase bei Männchen und Weibchen erhöht.
Histopathologisch wurde für die höchste Konzentration Hyperplasien in der Nasenpassage, dem Nasopharynx, Larynx, der trachealen Bifurkation und den Lungen in Verbindung mit nekrotischen und entzündlichen Veränderungen in Nasopharynx, Larynx und Lunge beschrieben. Mit Ausnahme der nasalen Veränderungen sowie der Nekrosen am Larynx zeigten diese Veränderungen in der Nachbeobachtung eine Tendenz zur Reversibilität.Die Tiere der mittleren Konzentration zeigten die Veränderungen in geringerer Ausprägung.
Die Luftkonzentration von 10 mg/m3 führte zu eosinophilen Einschlüssen in der Nasenpassage der Tiere, die in vergleichbarer Inzidenz und Schwere auch in den Kontrolltieren beschrieben wurden, deren Schweregrad mit steigender Luftkonzentration zunahm. Die für die männlichen Tiere beschriebenen Hyperplasien/Einzelzellnekrosen des olfaktorischen Epithelszeigen keine klare Dosisabhängigkeit und wurden in ihrer Bedeutung als fraglich eingeschätzt. Die Konzentration von 10 mg/m3 wird daher als NOAEL betrachtet. Details zu den Veränderungen sind in den Tabellen 5a ( ) und 5b (
) und 5b ( ) wiedergegeben.
) wiedergegeben.
Tabelle 4a: Ergebnisse der 14-Tage-Inhalationsstudien an männlichen Sprague-Dawley-Ratten
| Konzentration | Klinische und makroskopische Beobachtungen | Mikroskopische Veränderungen |
| 0 mg/m3 | ohne Befund | ohne Befund |
| 11 mg/m3 (Dampf) | ohne Befund | ohne Befund |
| 44 mg/m3 (Dampf) | halbgeschlossene Augen, Salivation, braune Verfärbung um die Schnauze, Niesen Lymphknoten: vergrößert (minimal) (1/5) | Nasenpassage: Becherzellhyperplasie im Nasenseptum (1/5) |
| 191 mg/m3 (Aerosol) | halbgeschlossene Augen, Salivation, braune Verfärbung um die Schnauze,Niesen, geräuschvolle Atmung Lymphknoten: vergrößert (zervikal) (3/5), Körpergewicht reduziert, abs. Lungengewicht reduziert | Nasenpassage: hyperplastische und entzündliche Veränderungen im respiratorischen (2/5) Epithel, Becherzellhyperplasie im Nasenseptum (4/5) Trachea: Larynx: Lunge: |
| 1019 mg/m3 (Aerosol) nach 4 Tagen abgebrochen | halbgeschlossene, geschlossene Augen., Salivation, braune Verfärbung um Schnauze und Augen; geräuschvolle Atmung, Lethargie, reduzierte Körpertemperatur, unsicherer Gang, Keuchen, gekrümmte Körperhaltung, Niesen, Körpergewicht reduziert Lymphknoten vergrößert (4/5) abs. Lungengewicht reduziert | Nasenpassage: Hyperplasie mit Entzündungen im respiratorischen Epithel (4/5),Plattenepithelmetaplasie des respiratorischen Epithels (5/5), Hyperplasiedes respiratorischen Epithels / Übergangsepithels (4/5), Atrophie oder Nekrose des Plattenepithels- oder respiratorischen Epithels (3/5), Haemorrhagie in der Lamina propria (1/5) Larynx: Trachea: Lunge: |
Tabelle 4b: Ergebnisse der 14-Tage-Inhalationsstudien an weiblichen Sprague-Dawley-Ratten
| Konzentration | Klinische und makroskopische Beobachtungen | Mikroskopische Veränderungen |
| 0 mg/m3 | ohne Befund | ohne Befund |
| 11 mg/m3 (Dampf) | ohne Befund | ohne Befund |
| 44 mg/m3 (Dampf) | halbgeschlossene Augen, Salivation, braune Verfärbung um die Schnauze, Niesen | Nasenpassage: Hyperplasie mit Entzündungen im respiratorischen Epithels (2/5) und Übergangsepithel (1/5) |
| 191 mg/m3 (Aerosol) | halbgeschlossene Augen, Salivation, braune Verfärbung um die Schnauze,Niesen, geräuschvolle Atmung, Körpergewicht reduziert, abs. Lungengewicht reduziert | Nasenpassage : Hyperplasie mit Entzündungen im respiratorischen Epithels (2/5) und Übergangsepithel (2/5), Becherzellhyperplasie im Nasenseptum (1/5), Haemorrhagie in der Lamina propria (1/5) Larynx: Lunge: |
| 1019 mg/m3 (Aerosol) nach 4 Tagen abgebrochen | halbgeschlossene Augen. Salivation, braune Verfärbung um die Schnauze, Niesen, geräuschvolle Atmung, Lethargie, niedrige Körpertemperatur; unsicherer Gang Körpergewicht reduziert absolutes Lungengewicht reduziert | Nasenpassage: Hyperplasie mit Entzündungen im respiratorischen Epithel (4/5), Plattenepithelmetaplasie des respiratorischen Epithels / Übergangsepithels(3/5), Ulzeration mit Reepithelisierung (1/5), Atrophie / Nekrose des Plattenepithels / respiratorischen Epithels (3/5), Haemorrhagie in der Lamina propria (2/5), entzündliche Exsudate (3/5), mukosale Nekrose (1/5) Larynx: Trachea: Lunge: |
Tabelle 5a: Ergebnisse der 90-Tage-Inhalationsstudie an männlichen Sprague-Dawley-Ratten
| Konzentration | Klinische und makroskopische Beobachtungen | Mikroskopische Veränderungen |
| 0 mg/m3 | ohne Befund | Nasenpassage: eosinophile Einschlüsse im olfaktorischen Epithel (10/10, Spur) Nasopharynx, Larynx, Trachea und Lunge: ohne Befund |
| 10 mg/m3 (Dampf) | ohne Befund | Nasenpassage: olfaktorisches Epithel: Hyperplasie (2/10, Spur) / Einzelzellnekrose (2/10Spur), eosinophile Einschlüsse (10/10, Spur) Nasopharynx: Larynx, Trachea und Lunge: |
| 60 mg/m3 (Dampf) | vergrößerte tracheobronchiale Lymphknoten (1/10) | Nasenpassage:Übergangsepithel Becherzellhyperplasie (10/10) und Hyperplasie im respiratorischen Epithel/ (4/10, Spur; 1/10, minimal), olfaktorische epitheliale Hyperplasie (7/10, minimal) / Einzelzellnekrose(3/10, Spur), eosinophile Einschlüsse im olfaktorischen Epithel (10/10, moderat) und respiratorischen Epithel Nasopharynx: Larynx: Trachea: Lunge: |
| 153 mg/m3 (Dampf & Aerosol) | halbgeschlossene Augen, Lecken im Maul, ausgeprägte Atmung, raue Schnauze, geräuschvolle Atmung und generalisierte braune Verfärbunggeringeres Körpergewicht und reduzierte Futteraufnahme vergrößerte tracheobronchiale Lymphknoten (3/10) | Nasenpassage: Übergangsepithel Becherzellhyperplasie (10/10) und Hyperplasie im respiratorischen Epithel/ (2/10, Spur; 2/10, minimal), olfaktorische epitheliale Hyperplasie (1/10, minimal) / Einzelzellnekrose (1/10 Spur) sowie respiratorischen Nasopharynx: Larynx: Trachea: Lunge: |
| 153 mg/m3 (Dampf & Aerosol) Recovery | abs. & rel. Lungengewicht erhöht | Nasenpassage: Übergangsepithel Becherzellhyperplasie (8/10, minimal); Hyperplasie im respiratorischen Epithel/ (1/10, minimal), eosinophile Einschlüsse im olfaktorischen (10/10, moderatausgeprägt) und respiratorischen Nasopharynx: Larynx: Trachea: Lunge: |
Tabelle 5b: Ergebnisse der 90-Tage-Inhalationsstudie an weiblichen Sprague-Dawley-Ratten
| Konzentration | Klinische und makroskopische Beobachtungen | Mikroskopische Veränderungen |
| 0 mg/m3 | ohne Befund | Nasenpassage: eosinophile Einschlüsse im olfaktorischen Epithel (10/10, Spur) Nasopharynx: |
| 10 mg/m3 (Dampf) | ohne Befund | Nasenpassage: eosinophile Einschlüsse im olfaktorischen Epithel (10/10, Spurminimal) Nasopharynx, Larynx, Trachea und Lunge: ohne Befund NOAEL |
| 60 mg/m3 (Dampf) | ohne Befund | Nasenpassage: Becherzellhyperplasie (10/10), Hyperplasie im respiratorischen Epithel/Übergangsepithel (1/10, Spur), eosinophile Einschlüsse im olfaktorischen (10/10, moderat) und respiratorischen Epithel Nasopharynx: Larynx: Trachea: Lunge: |
| 153 mg/m3 (Dampf & Aerosol) | halbgeschlossene Augen, Lecken im Maul, ausgeprägte, geräuschvolle Atmung, raue Schnauze, generalisierte braune Verfärbung
geringeres Körpergewicht und reduzierte Futteraufnahme vergrößerte tracheobronchiale Lymphknoten Lungengewicht (abs. & rel.), Nebennierengewicht (abs.) und Milzgewicht (rel.) erhöht |
Nasenpassage: Becherzellhyperplasie (10/10), Hyperplasie im respiratorischen Epithel/Übergangsepithel (1/10, Spur; 4/10, minimal), eosinophile Einschlüsse im olfaktorischen (10/10, moderat ausgeprägt) und respiratorischen Epithel Nasopharynx: Larynx: Trachea: Lunge: Ovarien: |
| 153 mg/m3 (Dampf & Aerosol) Recovery | Lungengewicht (abs.), Nebennierengewicht (abs.) und Ovariengewicht (abs.) erhöht | Nasenpassage: Becherzellhyperplasie (10/10, minimal), Hyperplasie im respiratorischen Epithel/Übergangsepithel(3/10, minimal; 1/10, moderat), eosinophile Einschlüsse im olfaktorischen (10/10, moderatausgeprägt); undrespiratorischen Epithel (10/10, minimal), olfaktorische epitheliale Hyperplasie/Einzelzellnekrose (7/10), Plattenepithelmetaplasie im respiratorischen Epithel (3/10, Spur - minimal) Nasopharynx: Larynx: Trachea: Lunge: Ovarien: |
Wirkung auf Haut und Schleimhäute
In einem Hautreiztest führte 2-(Hydroxyethoxyethyl)-2-azabicyclo[2.2.1]heptan unverdünnt zu Erythemenund Ödemen (Mercier, 1991). Auf einen Augenreiztest wurde aufgrund der stark alkalischen Reaktion des Stoffes verzichtet.
Die akute, dermale Bestimmung der LD50 resultierte währendder 14-tägigen Beobachtungsphase in Nekrosen im Bereich der behandelten Areale der Rückenhaut, deren Ausmaß dosisabhängig zunahm. Bei Auftrag von mehr als 0,5 mg/kg unverdünnter Substanz kam es zurvollständigen Abstoßung der mit der Testsubstanz behandelten Hautfläche (Hapke & Kietzmann, 1987b).
Allergene Wirkung
Ein Maximierungstest nach Magnusson und Kligman ergab keine Hinweise aufein hautsensibilisierendes Potential von 2-(Hydroxyethoxyethyl)-2-azabicyclo[2.2.1]heptan (Mercier, 1991).
Reproduktionstoxizität
Es liegen keine spezifischen Studien zu den Endpunkten Entwicklungsschädigung oder Fertilität vor.2-(Hydroxyethoxyethyl)-2-azabicyclo[2.2.1]heptan zeigte in den vorliegendensubakuten und subchronischen Studien in Einzelfällen Wirkung auf die Ovarien und die Hoden. Es kann nicht zwingend ausgeschlossen werden, dassder Stoff oder ein Metabolit die Fortpflanzungsorgane erreicht hat. Der Schweregrad der beobachteten Effekte lässt jedoch eine Einstufung als"fortpflanzungsgefährdend" auf der Grundlage des Leitfadens für die 1Einstufung (EU 1998) nicht zu. Die vorliegenden Hinweise sprechen daher nicht gegen die Ableitung eines Arbeitsplatzrichtwertes.
Mutagenität in vitro
Die Untersuchung des Stoffes in einem Platteninkubationstest zeigte sowohlmit als auch ohne metabolische Aktivierung keine Hinweise auf ein mutagenes Potential (Grötsch & Leimbeck, 1988).
in vivo
2-(Hydroxyethoxyethyl)-2-azabicyclo[2.2.1]heptan wurde in einem Mikronukleustestuntersucht. Der Stoff wurde in Wasser gelöst in Dosierungen von 241,1 mg/kg ( ) bzw. 436,8 mg/kg
) bzw. 436,8 mg/kg
( ) oral an jeweils 5CD-1-Mäuse verabreicht. Die Dosierungen wurden in einem Vorversuch zurakuten Toxizität ermittelt und entsprechen 50 - 80 % der LD50-Werte. Ein Tier der niedrigen Dosis und 4/10 Tiere der Hochdosisgruppe verstarben während des Versuches; Mikrokerne wurden nicht induziert. Das Verhältnis der polychromatischen zu den normochromatischen
) oral an jeweils 5CD-1-Mäuse verabreicht. Die Dosierungen wurden in einem Vorversuch zurakuten Toxizität ermittelt und entsprechen 50 - 80 % der LD50-Werte. Ein Tier der niedrigen Dosis und 4/10 Tiere der Hochdosisgruppe verstarben während des Versuches; Mikrokerne wurden nicht induziert. Das Verhältnis der polychromatischen zu den normochromatischen
Erythrozyten war im Vergleich zu den Vehikelkontrollen nicht verändert (McEnaney, 1990).
Kanzerogenität
Es liegen keine Studien vor, die eine Bewertung des Endpunktes Kanzerogenität erlauben würden.
Struktur-Wirkungs-Beziehungen
Untersuchungen zur akuten Inhalationstoxizität sowie zu der subakutenund subchronischen Inhalation mit dem strukturverwandten Stoff2-Methyl-2-azabicyclo[2.2.1]heptan zeigen ebenfalls überwiegend lokale Effekte auf Nasenpassage, Nasopharynx, Larynx, Trachea und, in geringerem Maße, Lunge.
Ableitung des ARW
Die vorliegenden Daten zur Mutagenität sprechen derzeit nicht gegendie Ableitung eines ARW-Wertes. Daten zur Kanzerogenität und zur Reproduktionstoxizität liegen nicht vor. Die in den Studien mit wiederholter Verabreichung beobachteten Veränderungen an den Hoden und Ovarien stellenkein Hindernis für die Ableitung eines ARW dar. Auch die chemische Strukturlässt keine Anhaltspunkte auf eine mutagene, kanzerogene oder reproduktionstoxische Wirkung erkennen.
2-(Hydroxyethoxyethyl)-2-azabicyclo[2.2.1]heptan zeigt nach oraler undinhalativer Gabe fast ausschließlich lokale Effekte. Die14-Tage-Inhalationsstudie zeigt den gleichen NOAEL wie die subchronische Inhalationsstudie; eine Zeitextrapolation des NOAEL ist daher bei der Ableitungdes ARW nicht erforderlich. Da für die beobachtete lokale Wirkung einermetabolischen Umwandlung des Stoffes nicht erforderlich scheint, kann einreduzierter Faktor für die Inter- und Intraspeziesextrapolation angewandtwerden. Auf der Grundlage dieser Überlegungen sowie des ARW-Konzeptes(Anon 1998) kann damit, ausgehend vom ermittelten NOAEL von 10mg/m3 (90 Tage) bzw. 11 mg/m3 (14 Tage) ein Grenzwert abgeleitet werden. Es sind folgende Extrapolationen zu berücksichtigen:
Extrapolationsschritt Faktor
- Versuchstier Ratte4 exponierter Arbeitnehmer 1
- 90-Tage-Exposition4 chronische Belastung 1
- Inter- & Intraspeziesvariabilitäten 1/2
Angesichts fehlender stoffspezifischer Daten ergibt sich unter Verwendungder genannten Faktoren für 2-(Hydroxyethoxyethyl)-2-azabicyclo[2.2.1]heptan ein Arbeitsplatzrichtwert von 5 mg/m3 (0,5 ppm).
Literatur
[1] Anon (1998) Kriterien für die Ableitung von gesundheitsbasierten Luftgrenzwerten bei limitierter Datenlage Bundesarbeitsblatt 10/98, 74-76
[2] Coombs, DW; Shepherd, CK; Bannerman, M; Gilkinson, IS; Hardy, CJ; Gopinath, C (1995a) Thancat AN 20-2-Week Repeat Dose Rangefinding Inhalation Toxicity Study in Rats unveröffentlichter Bericht des Huntingdon Research Centre Ltd., Project No.: RDa 2/950.602
[3] Coombs, DW; Shepherd, CK; Bannerman, M; Hardy, CJ; Crook, D; Gopinath, C (1995b) Thancat AN 20 - 13 Inhalation Toxicity Study in Ratsunveröffentlichter Bericht des Huntingdon Life Sciences Ltd., Project No.: RDa 4/951.775
[4] EU (1998) Richtlinie 67/548/EWG, Annex VI - Allgemeine Anforderungenfür die Einstufung und Kennzeichnung gefährlicher Stoffe und Zubereitungen Amtsblatt der Europäischen Gemeinschaften L225/263 Richtlinie 2001/59/EG der Kommission vom 6. August 2001 zur 28. Anpassung der Richtlinie67/548/EWG des Rates zur Angleichung der Rechts- und Verwaltungsvorschriftender Mitgliedstaaten für die Einstufung, Verpackung und Kennzeichnung gefährlicher Stoffe an den technischen Fortschritt
[5] Grötsch, W; Leimbeck R (1988) Mutagenitätsprüfung von Hydroxiethoxiethylazanorbornan im Ames Salmonella/Mikrosomen Platteninkubationstest unveröffentlichter Bericht der Gesellschaft für Mikrobiologie und biologische Qualitätsprüfung Labor L+S GmbH, Project No.: 0-0-79-88
[6] Hapke, HJ; Kietzmann; M (1987a) Bericht über Versuche zur Ermittlungder mittleren tödlichen Dosis bei Ratten nach einmaliger oraler Verabreichung eines Azanorbornans (Substanz 3) unveröffentlichter Berichtdes Instituts für Pharmakologie, Toxikologie und Pharmazie der Tierärztlichen Hochschule Hannover vom 30.03.1987
[7] Hapke, K-H; Kietzmann, M (1987b) Bericht über Versuche zur Ermittlungder mittleren tödlichen Dosis bei Ratten nach einmaliger dermaler Verabreichung eines Azanorbornans (Substanz 3) unveröffentlichter Berichtdes Instituts für Pharmakologie, Toxikologie und Pharmazie der Tierärztlichen Hochschule Hannover vom 14.04.1987
[8] Kalberlah, F; Schneider, K; Schuhmacher, US; Voss, JU; Ioannidis, I;Oltmanns, J (1999) Zeitextrapolation und Interspeziesextrapolation bei lokalwirksamen Stoffen mit begrenzter Datenlage Schriftenreihe der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin, Forschungsbericht Fb 862
[9] Leuschner, J; Leuschner, F; Neumann, B-W; Stehr, G (1990a) Acute Toxicity Study of Thancat AN 20 by Oral Administration to Sprague-Dawley Ratunveröffentlichter Bericht der LPT Laboratory of Pharmacology and Toxicology, Project No.: 6046/90
[10] Leuschner, J; Leuschner, F; Neumann, B-W; Stehr, G (1990b) Thancat AN20 2-(2-Hydroxyethoxyethyl-)-2-azanorbornane Acute Inhalation Toxicity Studyin Sprague-Dawley Rat unveröffentlichter Bericht der LPT Laboratory of Pharmacology and Toxicology, Project No.: 6045/90
[11] Leuschner, F; Leuschner, J; Stehr, G; Dontenwill, W; Mitterer, K-E;Möller, E; Neumann, B-W (1991) 4-Week Subchronic Toxicity Study of ThancatAN 20 in Sprague-Dawley Rats by Administration in the Diet unveröffentlichter Bericht der LPT Laboratory of Pharmacology and Toxicology, Project No.: 6480/90
[12] McEnaney, S (1990) Study to Evaluate the Potential of Thancat AN 20to Induce Micronuclei in the Polychromatic Erythrocytes of CD-1 Mice unveröffentlichter Bericht von Hazleton Microtest, Project No.: Haz 18/MNT 786/1
[13] Mercier, O (1991) Test to Evaluate the Acute Primary Cutaneous Irritationand Corrosivity in the rabbit Test to Evaluate the Sensitizing Potentialin the Guinea-Pig - Guinea-Pig Maximization Test unveröffentlichter Bericht von Hazleton France, Project No.: 11.388
 |
weiter . |
(Stand: 20.08.2018)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: 90.- € netto (Grundlizenz)
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion