 in % vol
in % vol26,51 *
42,93 *
45,73 *
63,03 *
a Fruchtlikör: Splitwert *.
B Brandy: Blindduplikate.
C Whisky: Blindduplikate.
D Grappa: Splitwert *.
E Aquavit: Splitwert *.
F Rum: Splitwert *.
Verordnung (EG) Nr. 2870/2000 der Kommission vom 19. Dezember 2000 mit gemeinschaftlichen Referenzanalysemethoden für Spirituosen
(ABl. Nr. L 333 vom 29.12.2000 S. 20;
VO (EG) 2091/2002 - ABl. Nr. L 322 vom 27.11.2002 S. 11;
VO (EU) 2016/635 - ABl. Nr. L 108 vom::23.04.2016 S. 1Inkrafttreten)
Die Kommission der Europäischen Gemeinschaften -
gestützt auf den Vertrag zur Gründung der Europäischen Gemeinschaft,
gestützt auf die Verordnung (EWG) Nr. 1576/89 vom 29. Mai 1989 zur Festlegung der allgemeinen Regeln für die Begriffsbestimmung, Bezeichnung und Aufmachung von Spirituosen 1, geändert durch die Akte über den Beitritt Österreichs, Finnlands und Schwedens, insbesondere auf Artikel 4 Absatz 8,
in Erwägung nachstehender Gründe:
(1) Nach Artikel 4 Absatz 8 der Verordnung (EWG) Nr. 1576/89 ist es erforderlich, die bei Spirituosen anzuwendenden Analysemethoden festzulegen. Bei jeder amtlichen Kontrolle und im Streitfall sind Referenzmethoden anzuwenden, um zu gewährleisten, dass die Bestimmungen der Verordnung (EWG) Nr. 1576/89 und der Verordnung (EWG) Nr. 1014/90 der Kommission vom 24. April 1990 mit Durchführungsbestimmungen für die Begriffsbestimmung, Bezeichnung und Aufmachung von Spirituosen 2, zuletzt geändert durch die Verordnung (EG) Nr. 2140/98 3, eingehalten werden.
(2) Als gemeinschaftliche Referenzanalysemethoden sind nach Möglichkeit allgemein anerkannte Methoden festzulegen und zu beschreiben.
(3) Angesichts des wissenschaftlichen Fortschritts und der unterschiedlichen Ausrüstung der amtlichen Laboratorien sollte zugelassen werden, dass in Verantwortung des Laborleiters Analysemethoden verwendet werden, die auf anderen Messgrundsätzen beruhen als die Referenzmethoden gemäß dem Anhang dieser Verordnung, sofern diese anderen Analysemethoden ausreichende Zuverlässigkeitsbedingungen erfüllen - insbesondere die Kriterien gemäß den Bestimmungen der Richtlinie 85/591/EWG des Rates vom 20. Dezember 1985 zur Einführung gemeinschaftlicher Probenahmeverfahren und Analysemethoden für die Kontrolle von Lebensmitteln 4 - und sofern die Genauigkeit, Wiederholbarkeit und Vergleichbarkeit der Ergebnisse dieser anderen Analysemethoden nachweislich im Rahmen der Ergebnisse liegen, die mit den Referenzmethoden gemäß dieser Verordnung erzielt werden. Für den Fall der Erfüllung dieser Voraussetzung sollte die Anwendung anderer Analysemethoden zugelassen werden. Es sollte jedoch klargestellt werden, dass im Streitfall diese anderen Analysemethoden nicht die Referenzmethoden ersetzen können.
(4) Die in dieser Verordnung vorgesehenen Maßnahmen entsprechen der Stellungnahme des Anwendungsausschusses für Spirituosen
- hat folgende Verordnung erlassen:
Die Referenzanalysemethoden für Spirituosen, mit denen
die Erfüllung der Bedingungen der Verordnungen (EWG) Nr. 1576/89 und (EWG) Nr. 1014/90 sichergestellt werden kann, sind im Anhang dieser Verordnung aufgeführt.
Abweichend von Artikel 1 erster Gedankenstrich dürfen in Verantwortung des Laborleiters auch andere Analysemethoden verwendet werden, sofern Genauigkeit und Zuverlässigkeit (Wiederholbarkeit und Vergleichbarkeit) der Verfahren zumindest gleichwertig sind mit den im Anhang aufgeführten Referenzanalysemethoden.
Sind für den Nachweis und die Quantifizierung der in einer bestimmten Spirituose enthaltenen Stoffe keine gemeinschaftlichen Referenzanalysemethoden festgelegt, so sind folgende Analysemethoden zu verwenden:
Im Sinne dieser Verordnung sind
Diese Verordnung tritt am siebten Tag nach ihrer Veröffentlichung im Amtsblatt der Europäischen Gemeinschaften in Kraft.
Sie gilt ab 1. Januar 2001.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
2) ABl. Nr. L 105 vom 25.04.1990 S. 9.
3) ABl. Nr. L 270 vom 07.10.1998 S. 9.
4) ABl. Nr. L 372 vom 31.12.1985 S. 50.
| Beschreibung der Referenzanalysemethoden | Anhang |
I. Bestimmung des Alkoholgehalts in Volumen von Spirituosen
Einleitung
Die Referenzmethode umfasst zwei Anlagen:
Anlage I: Vorbereitung des Destillats
Anlage II: Messung der Volumenmasse des Destillats
1. Anwendungsbereich
Die Methode eignet sich für die Bestimmung des tatsächlichen Alkoholgehalts in Volumen von Spirituosen.
2. Normen
ISO 3696:1987 Wasser für Analysezwecke - Spezifikationen und Testverfahren
3. Benennungen und Definitionen
3.1. Referenztemperatur:
Die Referenztemperatur für die Bestimmung des Alkoholgehalts in Volumen, der Volumenmasse und der relativen Dichte von Spirituosen beträgt 20 °C.
Anmerkung 1: Die Angabe "bei t °C" ist für alle Bestimmungen (der Volumenmasse oder des Alkoholgehalts in Volumen) vorbehalten, die nicht bei der Referenztemperatur 20 °C ausgedrückt sind.
3.2. Volumenmasse:
Volumenmasse ist der Quotient aus der Masse eines bestimmten Volumens in vacuo einer Spirituose bei 20 °C und seinem Volumen, ausgedrückt in Kilogramm/Kubikmeter, Symbol ρ20 °Coderρ20.
3.3. Relative Dichte:
Relative Dichte bei 20 °C ist das in Dezimalen ausgedrückte Verhältnis der Volumenmasse von Spirituosen bei 20 °C zur Volumenmasse von Wasser bei 20 °C. Ihr Symbol ist d20 °C/20 °C oder d20/20, oder auch d, sofern eine Verwechslung ausgeschlossen ist. Das gemessene Merkmal darf in der Analysenbescheinigung nur anhand der obigen Symbole angegeben werden.
Anmerkung 2: Die relative Dichte lässt sich aus der Volumenmasse ρ20 bei 20 °C ableiten:
ρ20 = 998,203 x d20/20 oder d20/20 = ρ20/998,203, dabei = 998,203 = Volumenmasse des Wassers bei 20 ºC.
3.4. Tatsächlicher Alkoholgehalt in Volumen:
Der tatsächliche Alkoholgehalt in Volumen von Spirituosen entspricht der Anzahl Liter Ethylalkohol, die in 100 l eines Wasser-Alkohol-Gemischs mit der gleichen Volumenmasse wie die Spirituose nach Destillation enthalten sind. Die Referenzwerte für den Alkoholgehalt in Volumen (% vol) bei 20 °C nach Maßgabe der Volumenmasse der Wasser-Alkohol-Gemische bei 20 °C entsprechen den Angaben in der von der Internationalen Organisation für das gesetzliche Messwesen in ihrer Empfehlung Nr. 22 verabschiedeten internationalen Tabelle.
Die allgemeine Gleichung für die Beziehung zwischen Alkoholgehalt in Volumen und Volumenmasse des Wasser-Alkohol-Gemischs bei einer gegebenen Temperatur geht aus Kapitel 3 "Alkoholgehalt" des Anhangs der Verordnung (EWG) Nr. 2676/90 (ABl. Nr. L 272 vom 03.10.1990 S. 40) bzw. der Sammlung der Analysemethoden des Internationalen Weinamts (1994), S. 17, hervor.
Anmerkung 3: Bei Likören und Cremes, deren genaues Volumen sehr schwer zu messen ist, muss die Probe gewogen und zunächst der Alkoholgehalt in Masse berechnet werden.
Umrechnungsformel:
Alkoholgehalt in Volumen (% vol) = [ASM (% Masse) xr20 (Probe)] / [ρ20 (Alkohol)]
ASM = Alkoholgehalt in Masse
ρ20 (Alkohol) = 789,24 kg/m3
4. Prinzip
Nach der Destillation wird der Alkoholgehalt in Volumen des Destillats durch Pyknometrie, durch elektronische Dichtemessung oder durch Dichtemessung mit der hydrostatischen Waage bestimmt.
| Vorbereitung des Destillats | Anlage I |
1. Anwendungsbereich
Das Verfahren eignet sich für die Zubereitung von Destillaten zur Bestimmung des tatsächlichen Alkoholgehalts in Volumen von Spirituosen.
2. Prinzip
Die Spirituosen werden destilliert, um die Extraktstoffe (nichtdestillierende Stoffe) vom Ethylalkohol und anderen flüchtigen Bestandteilen zu trennen.
3. Reagenzien und Material
3.1. Puffergranulat.
3.2. Schaumverhinderungsemulsion in konzentrierter Form (für Likörcremes).
4. Gerätschaften
Übliches Laborgerät, insbesondere:
4.1. Wasserbad, thermostatisierbar auf 10 °C bis 15 °C.
Wasserbad, thermostatisierbar auf 20 °C (± 0,2 °C).
4.2. Messkolben (100 ml und 200 ml) der Klasse A, Präzisionsgarantie (± 0,1 % bzw. 0,15 %.
4.3. Destillationsapparat
4.3.1. Allgemeine Anforderungen
Der zu verwendende Destillationsapparat muss folgenden Spezifikationen entsprechen:
Die Wärmequelle muss über einen geeigneten Hitzeverteiler verfügen, um jegliches Anbrennen der Extraktstoffe zu vermeiden.
4.3.2. Abbildung 1 zeigt als Beispiel einen geeigneten Destillationsapparat, der Folgendes umfasst:
Anmerkung: Der vorstehend beschriebene Apparat ist für eine Probemenge von mindestens 200 ml vorgesehen. Das Gerät kann jedoch durch Verwendung eines kleineren Destillationskolbens auf kleinere Größe eingestellt werden, sofern ein Spritzaufsatz oder eine ähnliche Vorrichtung zur Vermeidung des Mitnahmeeffekts verwendet wird.
5. Aufbewahrung der Proben
Vor der Analyse werden die Proben bei Raumtemperatur aufbewahrt.
6. Verfahren
Vorbemerkung: Die Destillation kann auch nach dem von der IUPAC (1968) veröffentlichten Verfahren erfolgen.
6.1. Überprüfung des Destillationsapparats
Der verwendete Apparat muss folgende Leistungen erbringen:
Bei der Destillation von 200 ml Wasser-Alkohol-Lösung mit bekannter Konzentration von etwa 50 % vol darf der Alkoholverlust nicht mehr als 0,1 % vol betragen.
6.2. Spirituosen mit einem Alkoholgehalt von weniger als 50 % vol
200 ml der Spirituose werden in einen Messkolben eingemessen.
Die Temperatur dieser Flüssigkeit ist aufzuzeichnen oder diese ist bei Standardtemperatur (20 °C) zu halten.
Die Probe wird in den Rundbodenkolben des Destillationsapparats gegossen und der Messkolben dreimal mit rund 20 ml destilliertem Wasser ausgespült. Die Spülflüssigkeit ist jeweils mit in den Destillierkolben zu geben.
Anmerkung: Bei Spirituosen mit weniger als 250 g/l Trockenextrakt genügt es, mit 60 ml Spülflüssigkeit zu verdünnen; ansonsten ist zur Verhinderung einer Pyrolyse bei 300 g/l Trockenextrakt mit mindestens 70 ml, bei 400 g/l Trockenextrakt mit mindestens 85 ml und bei 500 g/l Trockenextrakt (Fruchtliköre oder Cremes) mit mindestens 100 ml zu verdünnen. Diese Mengen sind anteilmäßig an abweichende Probevolumen anzupassen.
Ein wenig Puffergranulat ( 3.1) (und Schaumverhinderungsemulsion bei Cremes) hinzufügen.
In den Original-200-ml-Messkolben, in dem das Destillat aufgefangen wird, werden 20 ml destilliertes Wasser gegeben. Anschließend kommt dieser Kolben in ein Kaltwasserbad (4.1) (10 °C bzw. - bei Spirituosen mit Anis - 15 °C).
Die Destillation vornehmen und dabei Mitnahme oder Verbrennen durch gelegentliches Schütteln des Kolbeninhalts vermeiden, bis das Destillationsniveau wenige Millimeter unter dem Eichstrich des Messkolbens liegt.
Nachdem die Temperatur des Destillats auf die Ausgangstemperatur ± 0,5 °C gefallen ist, muss bis zum Eichstrich mit destilliertem Wasser aufgefüllt und sorgfältig gemischt werden.
Dieses Destillat wird zur Bestimmung des Alkoholgehalts in Volumen (Anlage II) verwendet.
6.3. Spirituosen mit einem Alkoholgehalt über 50 % vol
100 ml der Spirituosen werden anhand eines 100-ml-Messkolbens abgemessen und in den Rundbodenkolben des Destillationsgeräts übergeführt.
Der Messkolben wird mehrfach mit destilliertem Wasser ausgespült und die Spülflüssigkeit jedes Mal mit in den Destillierkolben gegeben. Genügend Wasser verwenden, damit der Kolbeninhalt ungefähr 230 ml erreicht.
In einen 200-ml-Messkolben, in dem das Destillat aufgefangen wird, werden 20 ml destilliertes Wasser gegeben. Anschließend kommt dieser Kolben in ein Kaltwasserbad (4.1) (10 °C bzw. - bei Spirituosen mit Anis - 15 °C).
Unter gelegentlichem Schütteln destillieren, bis das Destillationsniveau wenige Millimeter unter dem Eichstrich des 200-ml-Messkolbens liegt.
Nachdem die Temperatur des Destillats auf die Ausgangstemperatur ± 0,5 °C gefallen ist, muss bis zum Eichstrich mit destilliertem Wasser aufgefüllt und sorgfältig vermischt werden.
Dieses Destillat wird zur Bestimmung des Alkoholgehalts in Volumen (Anlage II) verwendet.
Anmerkung: Der Alkoholgehalt der Spirituosen ist doppelt so hoch wie der Alkoholgehalt des Destillats.
| Messung der Volumenmasse des Destillats | Anlage II |
Methode A
Bestimmung des tatsächlichen Alkoholgehalts in Volumen der Spirituosen durch Pyknometrie
A.1. Prinzip
Der Alkoholgehalt wird anhand der Volumenmasse des pyknometrisch gemessenen Destillats bestimmt.
A.2. Reagenzien und Material
Falls nichts anderes angegeben ist, sind in der Analyse lediglich Reagenzien von anerkannter Analysequalität und Wasser von mindestens Grad 3 gemäß ISO-Definition 3696:1987 zu verwenden.
A.2.1. Natriumchloridlösung (2 % w/v)
Für einen Liter Lösung sind 20 g Natriumchlorid abzuwiegen und mit Wasser aufzufüllen.
A.3. Gerät und Ausrüstung
Übliches Laborgerät, insbesondere:
A.3.1. Analysewaage mit einer Ablesegenauigkeit von 0,1 mg.
A.3.2. Eingeschliffenes Thermometer mit 1/10 Gradeinteilung und einem Messbereich von 10 bis 30 °C. Das Thermometer muss geeicht oder anhand eines geeichten Thermometers überprüft worden sein.
A.3.3. Pyknometer aus Pyrexglas mit einem Fassungsvermögen von etwa 100 ml und einem herausnehmbaren eingeschliffenen Thermometer ( A.3.2). Am Pyknometer befindet sich seitlich ein 25 mm langes Röhrchen mit einem Innendurchmesser von höchstens 1 mm, das in einem eingeschliffenen konischen Teil endet. Andere Pyknometer gemäß Beschreibung ISO 3507, zum Beispiel von 50 ml, dürfen bei Eignung verwendet werden.
A.3.4. Taragefäß von gleichem äußerem Volumen (Genauigkeit < 1 ml) wie das Pyknometer und von gleicher Masse wie das mit einer Flüssigkeit mit der Dichte 1,01 (Natriumchloridlösung A.2.1) gefüllte Pyknometer.
A.3.5. Mantel mit Wärmeisolierung, der der Form des Pyknometers angepasst ist.
Anmerkung 1: Die Methode für die Bestimmung der Volumenmasse in vacuo von Spirituosen erfordert den Einsatz einer zweiarmigen Waage, eines Pyknometers und eines Taragefäßes desselben äußeren Volumens, so dass der Luftdruck jederzeit beseitigt werden kann. Mit einer einarmigen Waage läßt sich dieses einfache Verfahren anwenden, wenn das Taragefäß zur Berücksichtigung der zahlreichen Änderungen des Luftdrucks zusätzlich gewogen wird.
A.4. Verfahren
Vorbemerkungen: Nachstehendes Verfahren wird für den Einsatz eines 100-ml-Pyknometers zur Bestimmung des Alkoholgehaltes beschrieben; dieses liefert die größte Genauigkeit. Es kann jedoch auch ein kleineres Pyknometer, zum Beispiel von 50 ml, verwendet werden.
A.4.1. Eichung des Pyknometers
Die Eichung des Pyknometers umfasst die Bestimmung folgender Parameter:
A.4.1.1. Eichung bei Verwendung einer einarmigen Waage
Bestimmung
A.4.1.1.1. Das saubere trockene Pyknometer (P) wird gewogen.
A.4.1.1.2. Das Pyknometer wird sorgfältig mit destilliertem Wasser bei Raumtemperatur gefüllt, und das Thermometer wird angebracht.
Das Pyknometer wird sorgfältig abgewischt und in den Mantel mit Wärmeisolierung gesetzt. Das Gefäß wird durch Umkehren so lange geschüttelt, bis die am Thermometer abgelesene Temperatur konstant ist.
Das Pyknometer wird dann exakt auf den oberen Rand des seitlichen Röhrchens eingestellt. Die Temperatur t °C wird sorgfältig abgelesen und gegebenenfalls um die Ungenauigkeit der Thermometerskala korrigiert.
Das mit Wasser gefüllte Pyknometer (P1) wird gewogen.
A.4.1.1.3. Das Taragefäß (T0) wird gewogen.
A.4.1.1.4. Berechnung
A.4.1.2. Eichverfahren bei Verwendung einer zweiarmigen Waage
A.4.1.2.1. Das Taragefäß wird auf die linke Schale der Waage und das saubere und trockene Pyknometer mit seinem "Auffangstöpsel" auf die rechte Schale der Waage gestellt. Das Gleichgewicht wird hergestellt, indem auf die Pyknometer-Schale gekennzeichnete Massestücke, d. h. "p"-Gramm, gesetzt werden.
A.4.1.2.2. Das Pyknometer wird sorgfältig mit destilliertem Wasser bei Raumtemperatur gefüllt und und das Thermometer angebracht. Das Pyknometer wird sorgfältig abgewischt und in den Mantel mit Wärmeisolierung gesetzt. Das Gefäß wird durch Umkehren so lange geschüttelt, bis die am Thermometer abgelesene Temperatur konstant ist.
Das Pyknometer wird dann exakt auf den oberen Rand des seitlichen Röhrchens eingestellt. Dieses seitliche Röhrchen wird abgewischt, der Auffangstöpsel aufgesetzt; die Temperatur t °C wird sorgfältig abgelesen und gegebenenfalls um die Ungenauigkeit der Thermometerskala korrigiert.
Das mit Wasser gefüllte Pyknometer wird gewogen; dabei ist p' die Masse in Gramm, die zur Herstellung des Gleichgewichts erforderlich ist.
A.4.1.2.3. Berechnung
A.4.2. Bestimmung des Alkoholgehalts der Probe
A.4.2.1. Verwendung einer einarmigen Waage
A.4.2.1.1. Das Taragefäß wird gewogen, seine Masse ist T1.
A.4.2.1.2. Das mit dem vorbereiteten Destillat gefüllte Pyknometer (siehe Anhang I) wird gewogen, P2 ist seine Masse bei t °C.
A.4.2.1.3. Berechnung
Anmerkung 4: Es ist auch möglich, dass das Pyknometer in einem Wasserbad von 20 °C ± 0,2 °C verbleibt, wenn es bis zum Eichstrich gefüllt wird.
A.4.2.1.4. Ergebnis
Der tatsächliche Alkoholgehalt in Volumen wird unter Verwendung der Volumenmasse ρ20 anhand der nachstehend angegebenen Tabellen errechnet.
Bei der Tabelle mit dem Wert des Alkoholgehalts (% vol) bei 20 °C als Faktor der Volumenmasse bei 20 °C von Wasser-Alkohol-Gemischen handelt es sich um die Internationale Alkoholtabelle, die von der Internationalen Organisation für das gesetzliche Messwesen in ihrer Empfehlung Nr. 22 verabschiedet wurde.
A.4.2.2. Verwendung einer zweiarmigen Waage
A.4.2.2.1. Das mit dem vorbereiteten Destillat gefüllte Pyknometer (siehe Anhang I) wird gewogen, p'' ist seine Masse bei t °C.
A.4.2.2.2. Berechnung
A.5. Leistungsmerkmale der Methode (Präzision)
A.5.1. Statistische Ergebnisse des Ringversuchs
Bei einem internationalen Ringversuch ergaben sich nach einem international abgestimmten Verfahren [1] [2] folgende Daten:
| Jahr des Ringversuchs | 1.997 |
| Anzahl Laboratorien | 20 |
| Anzahl Proben | 6 |
| Proben | A | B | C | D | E | F |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 19 | 20 | 17 | 19 | 19 | 17 |
| Anzahl Ausreißer (Laboratorien) | 1 | - | 2 | 1 | 1 | 3 |
| Anzahl berücksichtigter Ergebnisse | 38 | 40 | 34 | 38 | 38 | 34 |
Mittelwert in % vol in % vol |
23,77 26,51 * |
40,04 | 40,29 | 39,20 42,93 * |
42,24 45,73 * |
57,03 63,03 * |
| Wiederholstandardabweichung (sr) in % vol | 0,106 | 0,176 | 0,072 | 0,103 | 0,171 | 0,190 |
| Relative Wiederholstandardabweichung (RSDr) (%) | 0,42 | 0,44 | 0,18 | 0,25 | 0,39 | 0,32 |
| Wiederholgrenze (r) in % vol | 0,30 | 0,49 | 0,20 | 0,29 | 0,48 | 0,53 |
| Vergleichstandardabweichung (sR) in % vol | 0,131 | 0,236 | 0,154 | 0,233 | 0,238 | 0,322 |
| Relative Vergleichstandardabweichung (RSDR) (%) | 0,52 | 0,59 | 0,38 | 0,57 | 0,54 | 0,53 |
| Vergleichgrenze (R) in % vol | 0,37 | 0,66 | 0,43 | 0,65 | 0,67 | 0,90 |
| Art der Proben: a Fruchtlikör: Splitwert *. B Brandy: Blindduplikate. C Whisky: Blindduplikate. D Grappa: Splitwert *. E Aquavit: Splitwert *. F Rum: Splitwert *. |
||||||
Methode B
Bestimmung des tatsächlichen Alkoholgehalts von Spirituosen - elektronische Dichtemessung (gestützt auf die Frequenz der Schwingung in der Zelle eines Biegeschwingers)
B.1. Prinzip
Die Volumenmasse der Flüssigkeit wird durch die elektronische Messung der Schwingungen eines schwingenden U-Rohrs bestimmt. Zur Durchführung dieser Messung wird die Probe in ein Schwingungssystem gegeben, dessen Eigenfrequenz durch die Masse der eingeführten Substanz verändert wird.
B.2. Reagenzien und Material
Falls nichts anderes angegeben ist, sind in der Analyse lediglich Reagenzien von anerkannter Analysequalität und Wasser von mindestens Grad 3 gemäß ISO 3696:1987 zu verwenden.
B.2.1. Azeton (CAS 666-52-4) oder reiner Alkohol.
B.2.2. Trockene Luft.
B.3. Gerät und Ausrüstung
Übliches Laborgerät, insbesondere:
B.3.1. Densimeter und Digitalanzeige
Die zu diesen Messungen einzusetzenden elektronischen Densimeter müssen die Volumenmasse in g/ml bis zu 5 Dezimalstellen anzeigen können.
Anmerkung 1: Das Densimeter muss auf eine völlig stabile und schwingungsfreie Unterlage gestellt werden.
B.3.2. Temperaturregelung
Die Leistungen des Densimeters werden nur eingehalten, wenn die Meßzelle mit einer integrierten Wärmeregelungsvorrichtung ausgerüstet ist, die die gleiche (0,02 °C) oder eine bessere Temperaturstabilität ermöglicht.
Anmerkung 2: Die exakte Feineinstellung und die Kontrolle der Temperatur in der Meßzelle sind außerordentlich wichtige Parameter, da ein Fehler von 0,1 °C zu einer Änderung der Volumenmasse in der Größenordnung von 0,1 kg/m3 führen kann.
B.3.3. Spritzen zur Injektion der Proben oder Autosampler.
B.4. Verfahren
B.4.1. Eichung des Densimeters
Bei der Erstinbetriebnahme muss das Gerät nach den Anweisungen des Herstellers geeicht werden. Es muss regelmäßig nachgeeicht und eine Kontrolle anhand eines garantierten Referenzstandards oder einer internen Referenzlösung des Labors vorgenommen werden, die mit einem garantierten Referenzstandard verbunden ist.
B.4.2. Bestimmung der Volumenmasse der Probe
B.4.2.1. Vor der Messung wird die Zelle erforderlichenfalls mit Azeton oder reinem Alkohol und trockener Luft zu reinigen und zu trocknen. Die Zelle mit der Probe wird gespült.
B.4.2.2. Die Probe wird (mit einer Spritze oder einem Autosampler) in die Zelle eingeführt, sodass diese vollständig gefüllt ist. Während des Einfüllens muss sichergestellt werden, dass alle Luftblasen vollständig beseitigt werden. Die Probe muss homogen sein und darf keine festen Teilchen enthalten. Gegebenenfalls müssen alle Schwebstoffe vor der Analyse ausgefiltert werden.
B.4.2.3. Nach der Stabilisierung der Messung ist die Volumenmasse ρ20 oder der vom Gerät angezeigte Alkoholgehalt aufzuzeichnen.
B.4.3. Ergebnis
Wird die Volumenmasse ρ20 verwendet, so ist der tatsächliche Alkoholgehalt anhand nachstehender Tabellen zu berechnen:
Als Tabelle mit dem Wert des Alkoholgehalts (% vol) bei 20 °C für eine gegebene Volumenmasse von Wasser-Alkohol-Gemischen bei 20 °C wird die von der Internationalen Organisation für das gesetzliche Messwesen in ihrer Empfehlung Nr. 22 verabschiedete internationale Tabelle verwendet.
B.5. Leistungsmerkmale der Methode (Präzision)
B.5.1. Statistische Ergebnisse des Ringversuchs
Bei einem internationalen Ringversuch ergaben sich nach einem international abgestimmten Verfahren [1] [2] folgende Daten:
| Jahr des Ringversuchs | 1.997 |
| Anzahl Laboratorien | 16 |
| Anzahl Proben | 6 |
| Proben | A | B | C | D | E | F |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 11 | 13 | 15 | 16 | 14 | 13 |
| Anzahl Ausreißer (Laboratorien) | 2 | 3 | 1 | - | 1 | 2 |
| Anzahl berücksichtigter Ergebnisse | 22 | 26 | 30 | 32 | 28 | 26 |
Mittelwert in % vol in % vol |
23,81 26,52 * |
40,12 | 40,35 | 39,27 43,10 * |
42,39 45,91 * |
56,99 63,31 * |
| Wiederholstandardabweichung (sr) in % vol | 0,044 | 0,046 | 0,027 | 0,079 | 0,172 | 0,144 |
| Relative Wiederholstandardabweichung (RSDr) (%) | 0,17 | 0,12 | 0,07 | 0,19 | 0,39 | 0,24 |
| Wiederholgrenze (r) in % vol | 0,12 | 0,13 | 0,08 | 0,22 | 0,48 | 0,40 |
| Vergleichstandardabweichung (sR) in % vol | 0,054 | 0,069 | 0,083 | 0,141 | 0,197 | 0,205 |
| Relative Vergleichstandardabweichung (RSDR) (%) | 0,21 | 0,17 | 0,21 | 0,34 | 0,45 | 0,34 |
| Vergleichgrenze (R) in % vol | 0,15 | 0,19 | 0,23 | 0,40 | 0,55 | 0,58 |
| Art der Proben: a Fruchtlikör: Splitwert *. B Brandy: Blindduplikate. C Whisky: Blindduplikate. D Grappa: Splitwert *. E Aquavit: Splitwert *. F Rum: Splitwert *. |
||||||
Methode C
Bestimmung des tatsächlichen Alkoholgehalts der Spirituosen durch Dichtemessung mit der hydrostatischen Waage
C.1. Prinzip
Der Alkoholgehalt von Spirituosen kann densimetrisch mit Hilfe der hydrostatischen Waage nach dem Archimedes-Prinzip gemessen werden, dem zufolge ein in eine Flüssigkeit eintauchender Körper durch diese einen Auftrieb erfährt, der gleich dem Gewicht der verdrängten Flüssigkeit ist.
C.2. Reagenzien und Material
Falls nichts anderes angegeben ist, sind während der Analyse nur Reagenzien von anerkannter Analysequalität und Wasser von mindestens Grad 3 gemäß ISO 3696:1987 zu verwenden.
C.2.1. Schwimmerreinigungslösung (Natriumhydroxid, 30 % w/v)
Für die Zubereitung von 100 ml Lösung werden 30 g Natriumhydroxid gewogen und mit Ethanol von 96 % vol aufgefüllt.
C.3. Gerät und Ausrüstung
Übliches Laborgerät, insbesondere:
C.3.1. Einarmige hydrostatische Waage; Empfindlichkeit 1 mg.
C.3.2. Schwimmer mit einem Volumen von mindestens 20 ml, eigens an die Waage angepasst, aufgehängt an einem Faden mit einem Durchmesser von höchstens 0,1 mm Durchmesser.
C.3.3. Messzylinder mit Eichstrich. Der Schwimmer muss vollständig in die im Glaszylinder befindliche, unter dem Eichstrich stehende Flüssigkeit eintauchen, so dass die Oberfläche der Flüssigkeit lediglich vom Faden durchschnitten wird. Der Innendurchmesser des Glaszylinders muss mindestens 6 mm mehr betragen als der Durchmesser des Schwimmers.
C.3.4. Thermometer (oder Temperaturmesssonde), Einteilung in Grad und Zehntelgrad von 10 bis 40 °C, auf 0,05 °C genau geeicht.
C.3.5. Von einer anerkannten Prüfstelle geeichte Gewichte.
Anmerkung 1: Auch eine zweiarmige Waage kann verwendet werden; das Prinzip ist in Kapitel 1 "Volumenmasse und relative Dichte" des Anhangs der Verordnung (EWG) Nr. 2676/90 (S. 7) beschrieben.
C.4. Verfahren
Zwischen jeder Messung sind Schwimmer und Messzylinder mit destilliertem Wasser zu reinigen, mit weichem, fusselfreiem Laborpapier anzuwischen und mit der Lösung, deren Volumenmasse zu bestimmen ist, zu spülen. Die Messungen sind durchzuführen, sobald die Apparatur wieder im Gleichgewicht ist, um den Alkoholverlust durch Verdampfen zu beschränken.
C.4.1. Eichung der Waage
Obgleich die Waagen im Allgemeinen mit einem internen Eichsystem ausgerüstet sind, muss die hydrostatische Waage mit Gewichten geeicht werden können, die von einer amtlichen Prüfstelle kontrolliert worden sind.
C.4.2. Eichung des Schwimmers
C.4.2.1. Der Glaszylinder wird bei einer Temperatur von 15 °C bis 25 °C, vorzugsweise aber bei etwa 20 °C, mit bidestilliertem Wasser (oder Wasser gleichwertiger Reinheit, z.B. mikrofiltriertes Wasser mit einer Leitfähigkeit von 18,2 MΩ/cm) bis zum Eichstrich gefÌllt.
C.4.2.2. Schwimmer und Thermometer werden eingetaucht und geschüttelt, danach wird die Volumenmasse der Flüssigkeit vom Gerät abgelesen; erforderlichenfalls wird die Ablesung auf den Wert für Wasser bei Messtemperatur korrigiert.
C.4.3. Kontrolle mittels Wasser-Alkohol-Lösung
C.4.3.1. Der Glaszylinder wird bei einer Temperatur von 15 °C bis 25 °C, vorzugsweise aber bei etwa 20 °C, mit einer Wasser-Alkohol-Lösung bekannten Gehalts bis zum Eichstrich gefüllt.
C.4.3.2. Schwimmer und Thermometer werden eingetaucht und geschüttelt, danach wird die Volumenmasse der Flüssigkeit (oder der Alkoholgehalt, falls das Gerät es erlaubt) vom Gerät abgelesen. Der so festgestellte Alkoholgehalt muß mit dem zuvor bestimmten Alkoholgehalt übereinstimmen.
Anmerkung 2: Diese Lösung mit bekanntem Alkoholgehalt kann auch anstelle von bidestilliertem Wasser zur Eichung des Schwimmers verwendet werden.
C.4.4. Messung der Volumenmasse eines Destillats (oder seines Alkoholgehalts, falls das Gerät es erlaubt)
C.4.4.1. Der Glaszylinder wird bis zum Eichstrich mit der Probe gefüllt.
C.4.4.2. Schwimmer und Thermometer werden eingetaucht und geschüttelt, danach wird die Volumenmasse der Flüssigkeit (oder der Alkoholgehalt, falls das Gerät es erlaubt) vom Gerät abgelesen. Falls die Volumenmasse bei t °C (ρt) berechnet wird, muss die Temperatur aufgezeichnet werden.
C.4.4.3. Der Wert ρt wird mittels der Tabelle über die Volumenmassen ρT für Wasser-Alkohol-Gemische (Tabelle II des Anhangs II der Sammlung der internationalen Methoden des Internationalen Weinamts (1994) S. 17 bis 29ff.) umgerechnet.
C.4.5. Reinigung des Schwimmers und des Glaszylinders
C.4.5.1. Der Schwimmer wird in die im Glaszylinder befindliche Reinigungslösung eingetaucht.
C.4.5.2. Eine Stunde lang einwirken lassen, wobei der Schwimmer periodisch in Drehung versetzt wird.
C.4.5.3. Reichlich unter fließendem Wasser, danach mit destilliertem Wasser spülen.
C.4.5.4. Mit weichem fusselfreiem Laborpapier abtrocknen.
Dieser Vorgang ist bei jeder Erstbenutzung des Schwimmers und dann nach Bedarf regelmäßig durchzuführen.
C.4.6. Ergebnis
Anhand der Volumenmasse ρ20 wird unter Verwendung nachstehender Tabellen der tatsächliche Alkoholgehalt errechnet:
Die Tabelle mit dem Wert des Alkoholgehalts (% vol) bei 20 °C nach Maßgabe der Volumenmasse von Wasser-Alkohol-Gemischen bei 20 °C ist die von der Internationalen Organisation für das gesetzliche Messwesen in ihrer Empfehlung Nr. 22 verabschiedete internationale Tabelle.
C.5. Leistungsmerkmale der Methode (Präzision)
C.5.1. Statistische Ergebnisse des Ringversuchs
Bei einem internationalen Ringversuch ergaben sich nach einem international abgestimmten Verfahren [1] [2] folgende Daten:
| Jahr des Ringversuchs | 1.997 |
| Anzahl Laboratorien | 12 |
| Anzahl Proben | 6 |
| Proben | A | B | C | D | E | F |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 12 | 10 | 11 | 12 | 11 | 9 |
| Anzahl Ausreißer (Laboratorien) | - | 2 | 1 | - | 1 | 2 |
| Anzahl berücksichtigter Ergebnisse | 24 | 20 | 22 | 24 | 22 | 18 |
Mittelwert in % vol in % vol |
23,80 26,51 * |
40,09 | 40,29 | 39,26 43,09 * |
42,38 45,89 * |
57,16 63,44 * |
| Wiederholstandardabweichung (sr) in % vol | 0,048 | 0,065 | 0,042 | 0,099 | 0,094 | 0,106 |
| Relative Wiederholstandardabweichung (RSDr) (%) | 0,19 | 0,16 | 0,10 | 0,24 | 0,21 | 0,18 |
| Wiederholgrenze (r) in % vol | 0,13 | 0,18 | 0,12 | 0,28 | 0,26 | 0,30 |
| Vergleichstandardabweichung (sR) in % vol | 0,060 | 0,076 | 0,073 | 0,118 | 0,103 | 0,125 |
| Relative Vergleichstandardabweichung (RSDR) (%) | 0,24 | 0,19 | 0,18 | 0,29 | 0,23 | 0,21 |
| Vergleichgrenze (R) in % vol | 0,17 | 0,21 | 0,20 | 0,33 | 0,29 | 0,35 |
| Art der Proben: a Fruchtlikör: Splitwert *. B Brandy: Blindduplikate. C Whisky: Blindduplikate. D Grappa: Splitwert *. E Aquavit: Splitwert *. F Rum: Splitwert *. |
||||||
Schaubild 1: Destillationsgerät zur Messung des tatsächlichen Alkoholgehalts in Volumen von Spirituosen
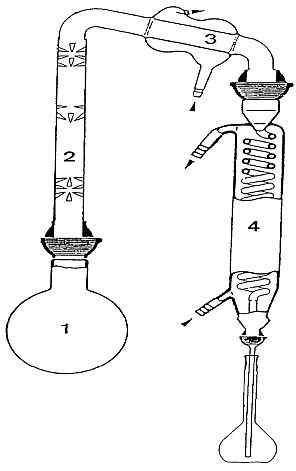
1. 1-1-Normalschliffkolben mit genormtem Rundglasstöpsel.
2. 20-cm-Vigreux-Rektifizierkolonne.
3. 10-cm-West-Kondensator mit geradem Rand.
4. 40-cm-Schlangenkühler.
II. Bestimmung des Gesamt-Trockenextrakts von Spirituosen durch Gravimetrie
1. Anwendungsbereich
Entsprechend der Verordnung (EWG) Nr. 1576/89 ist diese Methode lediglich für Aquavit vorgesehen, bei dem der Trockenextrakt nicht mehr als 15 g/l betragen darf.
2. Normen
ISO 3696:1987: Wasser für Analysezwecke - Spezifikationen und Testverfahren
3. Definition
Der Gesamt-Trockenextrakt oder die Gesamt-Trockensubstanz stellt die Gesamtmenge aller Substanzen dar, die sich unter bestimmten physikalischen Bedingungen nicht verflüchtigen.
4. Prinzip
Der nach Verdampfen der Spirituose über kochendem Wasserbad und Trocknen im Trockenofen verbleibende Rückstand wird gewogen.
5. Gerät und Ausrüstung
5.1. Flache zylindrische Verdampfungsschale mit 55 mm Durchmesser.
5.2. Kochendes Wasserbad.
5.3. 25-ml-Pipette, Klasse A.
5.4. Trockenofen.
5.5. Trockner.
5.6. Analysewaage mit einer Ablesegenauigkeit von 0,1 mg.
6. Probenahmen und Proben
Die Proben werden vor der Analyse bei Raumtemperatur aufbewahrt.
7. Verfahren
7.1. 25 ml der Spirituose mit weniger als 15 g/l Trockenmasse wird in eine zuvor gewogene flache zylindrische Verdampfungsschale mit 55 mm Durchmesser pipettiert. In der ersten Verdampfungsstunde wird die Verdampfungsschale an den Rand eines kochenden Wasserbades gesetzt, damit die Flüssigkeit nicht kocht, um Spritzverluste zu vermeiden. Danach wird die Schale eine Stunde lang unmittelbar in Kontakt mit dem Dampf des kochenden Wasserbades gebracht.
7.2. Der Trockenvorgang wird vervollständigt, indem die Schale für zwei Stunden in einen Trockenofen bei 105 °C ± 3 °C gestellt wird. Die Verdampfungsschale in einem Exsikkator abkühlen lassen und die Verdampfungsschale und ihren Inhalt wägen.
8. Berechnung
Die Rückstandsmasse vervielfältigt mit 40 entspricht dem in der Spirituose enthaltenen Trockenextrakt und wird bis zu einer Dezimalstelle in g/l ausgedrückt.
9. Leistungsmerkmale der Methode (Präzision)
9.1. Statistische Ergebnisse des Ringversuchs
Bei einem internationalen Ringversuch ergaben sich nach einem international abgestimmten Verfahren [1] [2] folgende Daten:
| Jahr des Ringversuchs | 1.997 |
| Anzahl Laboratorien | 10 |
| Anzahl Proben | 4 |
| Proben | A | B | C | D |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 9 | 9 | 8 | 9 |
| Anzahl Ausreißer (Laboratorien) | 1 | 1 | 2 | - |
| Anzahl berücksichtigter Ergebnisse | 18 | 18 | 16 | 18 |
Mittelwert in g/l in g/l |
9,0 | 9,1 7,8 |
10,0 9,4 |
11,8 11,1 |
| Wiederholstandardabweichung (sr) g/l | 0,075 | 0,441 | 0,028 | 0,123 |
| Relative Wiederholstandardabweichung (RSDr) (%) | 0,8 | 5,2 | 0,3 | 1,1 |
| Wiederholgrenze (r) g/l | 0,2 | 1,2 | 0,1 | 0,3 |
| Vergleichstandardabweichung (sR) g/l | 0,148 | 0,451 | 0,058 | 0,210 |
| Relative Vergleichstandardabweichung (RSDR) (%) | 1,6 | 5,3 | 0,6 | 1,8 |
| Vergleichgrenze (R) g/l | 0,4 | 1,3 | 0,2 | 0,6 |
| Art der Proben: a Brandy: Blindduplikate. B Rum: Splitwert *. C Grappa: Splitwert *. D Aquavit: Splitwert *. |
||||
III. Bestimmung der flüchtigen Bestandteile von Spirituosen
III.1. Allgemeine Bemerkungen
1. Definitionen
In der Verordnung (EWG) Nr. 1576/89 sind für eine Reihe von Spirituosen (Rum, Branntwein aus Weinbauerzeugnissen, Obstbrand usw.) ein Mindestgehalt an flüchtigen Bestandteilen außer Ethylalkohol und Methanol festgesetzt worden. Lediglich für diese Reihe von Getränken werden die genannten Werte herkömmlicherweise als äquivalent zur Summe der Konzentrationen folgender Stoffe angesehen:
Die herkömmlichen Methoden zur Bestimmung der flüchtigen Bestandteile sind folgende:
2. Analyse der flüchtigen Bestandteile durch Gaschromatographie
Gaschromatographische Untersuchungen anderer als der oben genannten flüchtigen Bestandteile können sich als besonders aufschlussreiches Mittel zur Bestimmung sowohl des Ursprungs des bei der Destillation verwendeten Rohmaterials als auch der tatsächlichen Destillationsbedingungen erweisen.
Verschiedene Spirituosen enthalten andere flüchtige Bestandteile wie Aromabestandteile, die für die jeweils zur Alkoholgewinnung verwendeten Ausgangsstoffe, das Aroma der Spirituose und die besonderen Merkmale der Spirituosenzubereitung kennzeichnend sind. Diese Bestandteile sind für die Beurteilung der Anforderungen nach Verordnung (EWG) Nr. 1576/89 von Bedeutung.
III.2. Bestimmung der flüchtigen Aromabestandteile von Spirituosen durch Gaschromatographie
1. Anwendungsbereich
Diese Methode eignet sich für die Bestimmung von 1,1-Diethoxyethan (Azetal), Methyl-2-Butanol-1 (Amylalkohol), Methyl-3-Butanol-1 (Isoamylalkohol), Methanol (Methylalkohol), Ethylethanoat (Ethylazetat), Butanol-1 (n-Butanol), Butan-2 (Trockenbutanol), Methyl-2-Propanol-1 (Isobutylalkohol), Propanol-1 (n-Propanol) und Ethanal (Azetaldehyd) in Spirituosen mittels Gaschromatographie. Bei der Methode wird ein interner Standard, z.B. Pentanol-3, verwendet. Die Analytenkonzentrationen werden als Gramm je 100 Liter Alkohol abs. ausgedrückt; der Alkoholgehalt des Erzeugnisses muss vor der Analyse bestimmt werden. Mit dieser Methode können folgende Spirituosen analysiert werden: Whisky, Brandy, Rum, Branntwein, Obstbrand und Tresterbrand.
2. Normen
ISO 3696:1987: Wasser für Laboranalysenverwendung - Spezifikationen und Testmethoden.
3. Definition
Aromabestandteile sind während der Gärung, Destillation und Reifung von Spirituosen gleichzeitig mit Ethanol gebildete flüchtige Stoffe.
4. Prinzip
Aromabestandteile in Spirituosen werden durch Direkteinspritzung der Spirituose oder einer entsprechend verdünnten Spirituose in einen Gaschromathographen (CG) bestimmt. Der Spirituose wird vor der Einspritzung ein angemessener interner Standard hinzugefügt. Die Aromabestandteile werden mit Hilfe eines Temperaturprogramms an geeigneter Kolonne abgetrennt und mit dem Flammenionisationsdetektor (FID) nachgewiesen. Dabei wird die Konzentration des einzelnen Aromabestandteils gegenüber dem internen Standard anhand von Reaktionsfaktoren bestimmt, die bei der Eichung unter identischen Chromatographiebedingungen wie bei der Analyse der Spirituose festgestellt werden.
5. Reagenzien und Material
Wenn nichts anderes angegeben ist, werden lediglich Reagenzien mit einer Reinheit von über 97 %, die bei einem von der ISO zugelassenen Lieferanten erworben wurden, für die ein Reinheitszeugnis gilt und die anlässlich der Testverdünnung frei von anderen Aromabestandteilen sind (dies lässt sich durch Einspritzung einzelner Aromabestandteilstandards bei Testverdünnung unter Gaschromatographiebedingungen gemäß 6.4 bestätigen), und ausschließlich Wasser von mindestens Grad 3 gemäß Definition ISO 3696 verwendet. Azetal und Azetaldehyd müssen im Dunkeln bei weniger als 5 °C, alle anderen Reagenzien bei Raumtemperatur aufbewahrt werden.
5.1. Reines Ethanol (CAS 64-17-5).
5.2. Methanol (CAS 67-56-1).
5.3. Propanol-1 (CAS 71-23-8).
5.4. Methyl-2-Propanol-1 (CAS 78-33-1).
5.5. Pentanol-3 (CAS 584-02-1). Geeignete interne Standards: Pentanol-3 (CAS 584-02-1), Pentanol-1 (CAS 71-41-0), Methyl-4-Pentanol-1 (CAS 626-89-1) oder Methylnonanoat (CAS 1731-84-6).
5.6. Methyl-2-Butanol-1 (CAS 137-32-6).
5.7. Methyl-3-Butanol-1 (CAS 123-51-3).
5.8. Ethylazetat (CAS 141-78-6).
5.9. Butanol-1 (CAS 71-36-3).
5.10. Butanol-2 (CAS 78-92-2).
5.11. Azetaldehyd (CAS 75-07-0).
5.12. Azetal (CAS 105-57-7).
5.13. Ethanollösung 40 % v/v.
Für die Zubereitung von 400 ml/l Ethanollösung werden 400 ml Ethanol ( 5.1) in einen 1-l-Meßkolben gegossen, das Volumen mit destilliertem Wasser aufgefüllt und sorgfältig vermischt.
5.14. Zubereitung und Aufbewahrung von Standardlösungen (Verfahren für die validierte Methode).
Alle Standardlösungen müssen bei weniger als 5 °C aufbewahrt und jeden Monat frisch zubereitet werden: Die Masse der Bestandteile und Lösungen ist bis 0,1 mg aufzuzeichnen.
5.14.1. Standardlösung - A
In einen 100-ml-Meßkolben mit ungefähr 60 ml Ethanollösung ( 5.13) werden folgende Reagenzien pipettiert, um die Verdampfung der Bestandteile so gering wie möglich zu halten; danach wird das Volumen mit Ethanollösung ( 5.13) aufgefüllt und sorgfältig vermischt. Das Gewicht des Kolbens, jedes einzelnen zugesetzten Stoffes und das Gesamtendgewicht des Inhalts ist aufzuzeichnen.
| Bestandteil | Masse (ml) |
| Methanol ( 5.2) | 3,0 |
| Propanol-1 ( 5.3) | 3,0 |
| Methyl-2-Propanol-1 ( 5.4) | 3,0 |
| Methyl-2-Butanol-1 ( 5.6) | 3,0 |
| Methyl-3-Butanol-1 ( 5.7) | 3,0 |
| Ethylazetat ( 5.8) | 3,0 |
| Butanol-1 ( 5.9) | 3,0 |
| Butanol-2 ( 5.10) | 3,0 |
| Acetaldehyd ( 5.11) | 3,0 |
| Azetal ( 5.12) | 3,0 |
Anmerkung 1: Azetal und Azetaldehyd sollten vorzugsweise zuletzt hinzugefügt werden, um die Verdampfungsverluste so klein wie möglich zu halten.
5.14.2. Standardlösung - B
In einen 100-ml-Messkolben mit ungefähr 80 ml Ethanollösung ( 5.13) werden 3 ml Pentanol-3 oder ein anderer geeigneter interner Standard ( 5.5) pipettiert und das Volumen mit Ethanollösung ( 5.13) aufgefüllt und sorgfältig vermischt.
Das Gewicht des Kolbens, das Gewicht von Pentanol-3 oder eines anderen internen Standards sowie das Gesamtendgewicht des Inhalts werden aufgezeichnet.
5.14.3. Standardlösung - C
In einen 100-ml-Messkolben mit ungefähr 80 ml Ethanollösung ( 5.13) werden 1 ml Lösung a ( 5.14.1) und 1 ml Lösung B ( 5.14.2) pipettiert und das Volumen mit Ethanollösung ( 5.13) aufgefüllt und sorgfältig vermischt.
Das Gewicht des Kolbens, jeder zugefügte Bestandteil und das Gesamtendgewicht des Inhalts werden aufgezeichnet.
5.14.4. Standardlösung - D
Zum Schutz der Analysekontinuität wird eine Qualitätskontrollnorm vorbereitet, wobei die früher hergestellte Norm a ( 5.14.1) verwendet wird. Dabei wird in einen 100-ml-Messkolben mit ungefähr 80 ml Ethanollösung ( 5.13) und 1 ml Lösung a ( 5.14.1) pipettiert und mit Ethanollösung ( 5.13) aufgefüllt und sorgfältig vermischt.
Das Gewicht des Kolbens, jeder zugefügte Bestandteil und das Gesamtendgewicht des Inhalts werden aufgezeichnet.
5.14.5. Standardlösung - E
In einen 100-ml-Messkolben mit ungefähr 80 ml Ethanollösung ( 5.13) werden 10 ml Lösung B ( 5.14.2) pipettiert und mit Ethanollösung ( 5.13) aufgefüllt und sorgfältig vermischt.
Das Gewicht des Kolbens, jedes einzelnen zugefügten Bestandteils und das Gesamtendgewicht des Inhalts werden aufgezeichnet.
5.14.6. Zur Überprüfung der Linearreaktion von FID verwendete Standardlösungen
In getrennte 100-ml-Messkolben mit ungefähr 80 ml Ethanollösung ( 5.13) werden 0, 0,1, 0,5, 1,0 bzw. 2,0 ml Lösung a ( 5.14.1) und 1 ml Lösung B ( 5.14.2) pipettiert, mit Ethanollösung ( 5.13) aufgefüllt und sorgfältig vermischt.
Das Gewicht des Kolbens, jedes einzelnen zugefügten Bestandteils und das Gesamtendgewicht des Inhalts werden aufgezeichnet.
5.14.7. QC-Standardlösung
In eine Waagschale werden 9 ml Standardlösung D ( 5.14.4) und 1 ml Standlösung E ( 5.14.5) pipettiert und sorgfältig vermischt.
Das Gewicht des Kolbens, jedes einzelnen zugefügten Bestandteils und das Gesamtendgewicht des Inhalts werden aufgezeichnet.
6. Gerät und Ausrüstung
6.1. Gerät für die Bestimmung der Volumenmasse und des Alkoholgehalts.
6.2. Analysewaage zur Messung bis vier Dezimalstellen.
6.3. Gaschromatograph mit Temperaturprogramm mit einem Flammenionisationsdetektor und Integrator oder sonstigem Datenverarbeitungssystem zur Bestimmung von Peakflächen oder Peakhöhen.
6.4. Gaschromatographiesäule(n) zur Abtrennung von Analyten, wobei die Mindestauflösung zwischen den Einzelbestandteilen (außer Methyl-2-Butanol-1 und Methyl-3-Butanol-1) mindestens 1,3 betragen muss.
Anmerkung 2: Folgende Säulen und GC-Bedingungen sind Beispiele, die sich als geeignet erwiesen haben:
- Eine Retentionslücke 1 m x 0,32 mm i.d. wird an eine CP-WAX-57-CB-Säule 50 m x 0,32 mm i.d. 0,2
µm Filmstärke (stabilisiertes Polyäthylenglycol) und danach an eine Carbowax 400-Säule 50 m x 0,32 mm i.d. 0,2 µm Filmstärke angeschlossen. (Die Säulen werden mit Press-fit-Anschlüssen verbunden.)
Trägergas und Druck: Helium (135 kPa) Säulentemperatur: 35 °C während 17 min, 35 °C bis 70 °C bei 12 °C/min, 70 °C während 25 min Injektortemperatur: 150 °C Detektortemperatur: 250 °C Injektionsvolumen: 1 µl, Split 20 bis 100:1 - Eine Retentionslücke 1 m x 0,32 mm i.d. wird an eine CP-WAX-57-CB-Säule 50 m x 0,32 mm i.d. 0,2
µm Filmstärke (stabilisiertes Polyethylenglycol) angeschlossen. (Die Retentionslücke wird mit Press-fit-Anschluss verbunden.)
Trägergas und Druck: Helium (65 kPa) Säulentemperatur: 35 °C während 10 min, 35 bis 110 °C bei 5 °C/min, 110 °C bis 190 °C bei 30 °C/min, 190 °C während 2 min Injektortemperatur: 260 °C Detektortemperatur: 300 °C Injektionsvolumen: 1 µl, split 55:1 - Eine bepackte Säule (5 % CW 20M, Carbopak B), 2 m x 2 mm i.d.
Säulentemperatur: 65 °C während 4 min, 65 °C bis 140 °C bei 10 °C/min, 140 °C während 5 min, 140 °C bis 150 °C bei 5 °C/min, auf 150 °C während 3 min Injektortemperatur: 65 °C Detektortemperatur: 200 °C Injektionsvolumen: 1 µl
7. Probenahmen und Proben
7.1. Laboratoriumsprobe
Der Alkoholgehalt jeder einzelnen Probe wird beim Erhalt gemessen ( 6.1).
8. Verfahren (Verfahren für die validierte Methode)
8.1. Testmenge
8.1.1. Eine geeignete versiegelte Waagschale wird gewogen und das Gewicht aufgezeichnet.
8.1.2. In die Schale werden 9 ml der Laborprobe pipettiert und das Gewicht (MPROBE) aufgezeichnet.
8.1.3. 1 ml der Standardlösung E ( 5.14.5) werden hinzugefügt und das Gewicht (MIS) aufgezeichnet.
8.1.4. Die Probe wird kräftig geschüttelt (mindestens 20 Bewegungen). Die Proben müssen vor der Analyse bei weniger als 5 °C aufbewahrt werden, um Flüchtigkeitsverluste so klein wie möglich zu halten.
8.2. Blindversuch
8.2.1. Auf einer Stellwaage mit vier Dezimalstellen ( 6.2) wird eine geeignete versiegelte Waagschale gewogen und das Gewicht aufgezeichnet.
8.2.2. 9 ml der 400-ml/l-Ethanollösung ( 5.13) werden in die Schale pipettiert und das Gewicht aufgezeichnet.
8.2.3. 1 ml Standardlösung E ( 5.14.5) werden hinzugefügt und das Gewicht aufgezeichnet.
8.2.4. Das Testmaterial wird kräftig (mindestens 20 Bewegungen) geschüttelt. Die Proben müssen vor der Analyse bei weniger als 5 °C aufbewahrt werden, um Flüchtigkeitsverluste so klein wie möglich zu halten.
8.3. Vorversuch
Die Standardlösung C ( 5.14.3) wird eingespritzt, um sicherzustellen, dass sämtliche Analyten (mit Ausnahme von Methyl-2-Butanol-1 und Methyl-3-Butanol-1) mit einer Mindestauflösung von 1,3 getrennt werden.
8.4. Eichung
Die Eichung ist nach folgendem Verfahren zu überprüfen: Jede der den internen Standard (IS) enthaltenden Linearstandardlösungen ( 5.14.6) wird nacheinander dreifach analysiert, wobei die Reaktion linear ausfallen muss. Aufgrund der Integratorpeakflächen oder -peakhöhen wird für jede Injektion das Verhältnis R für die einzelnen Aromabestandteile berechnet und eine Kurve aus R und dem Konzentrationsverhältnis des Aromabestandteils zum internen Standard (IS), C, erstellt. Dabei müsste sich eine lineare Kurve mit einem Korrelationseffizienten von mindestens 0,99 ergeben.
R = Peakfläche oder -höhe des Aromabestandteils / Peakfläche oder -höhe von IS
C = Konzentration des Aromabestandteils (µg/g) / Konzentration von IS (µg/g)
8.5. Bestimmung
Die Standardlösung C ( 5.14.3) und 2 QC-Standardlösungen ( 5.14.7) werden eingespritzt. Anschließend werden unbekannte Proben (Zubereitung gemäß 8.1 und 8.2) zugefügt, wobei für analytische Stabilität bei jeder zehnten Probe ein QC-Standard eingesetzt wird. Nach jeder fünften Probe wird eine Standardlösung C ( 5.14.3) eingespritzt.
9. Berechnung
Für die Behandlung der Daten kann ein automatisches System verwendet werden, sofern die Daten anhand der in nachstehender Methode beschriebenen Prinzipien überprüfbar sind.
Für die Peaks der Aromabestandteile und der internen Standards sind entweder die Peakflächen oder die Peakhöhen zu messen.
9.1. Berechnung des Reaktionsfaktors
Aus dem Chromatogramm der Injektion der Standardlösung C ( 5.14.3) werden die Reaktionsfaktoren für jeden Aromabestandteil anhand der Gleichung ( 1) berechnet.
(1) Reaktionsfaktor = [Peakfläche oder -höhe IS / Peakfläche oder -höhe Aromabestandteil] x [Konz. Aromabest. (µg/g) / Konz. IS (µg/g)]
dabei sind:
IS = Interner Standard
Konz. Aromabest. = Konzentration des Aromabestandteils C ( 5.14.3)
Konz. IS = Konzentration des internen Standards in der Lösung C ( 5.14.3).
9.1.2. Probenanalyse
Die Konzentration des einzelnen Aromabestandteils in den Proben wird mit nachstehender Gleichung ( 2) errechnet.
(2) Konzentrationen der Aromabestandteile (µg/g) = [Peakfläche oder -höhe des Aromabestandteils / Peakfläche oder -höhe IS] x [MIS (g) / MPROBE (g)] x Konz. IS (µg/g) x RF
dabei sind
MPROBE = Gewicht der Probe ( 8.1.2)
MIS = Gewicht des internen Standards ( 8.1.3)
Konz. IS = Konzentration des internen Standards in Lösung E ( 5.14.5)
RF = Reaktionsfaktor berechnet mit Gleichung 1.
9.1.3. Analyse der Qualitätskontrollstandardlösung
Mit der nachstehenden Gleichung ( 3) wird der Rückgewinnungsprozentsatz des Zielwertes für jeden einzelnen Aromabestandteil in den Qualitätskontrollnormen ( 5.14.7) errechnet:
(3) % Rückgewinnung der Qualitätskontrollprobe = (Konz. des Analyten im Qualitätskontrollstandard / Konz. des Analyten in Lösung D) x 100
Die Konzentration des Analyten im Qualitätskontrollstandard wird anhand obiger Gleichungen ( 1) und ( 2) errechnet.
9.2. Abschließende Darstellung der Ergebnisse
Die Ergebnisse werden aus µg/g anhand folgender Gleichungen ( 4) in g je 100 Liter Alkohol abs. umgerechnet:
(4) Konzentration in g je 100 Liter Alkohol abs. = Konz. (µg/g) x ρx 10/(Gehalt (in % vol) x 1.000),
dabei ist
ρ = Volumenmasse in Kg/m3.
Die Ergebnisse werden in drei signifikanten Zahlen mit höchstens einer Dezimalstelle ausgedrückt, und zwar 11,4 g je 100 Liter Alkohol abs.
10. Qualitätssicherung und -kontrolle (bei der validierten Methode)
Mit obiger Gleichung ( 2) wird die Konzentration des einzelnen Aromabestandteils in den Qualitätskontrollstandardlösungen, wie sie nach dem Verfahren gemäß 8.1.1 bis 8.1.4 hergestellt wurden, errechnet. Mit der Gleichung ( 3) wird der Rückgewinnungssatz des Zielwertes errechnet. Liegen die erzielten Ergebnisse innerhalb ± 10 % der theoretischen Werte der einzelnen Aromabestandteile, so kann die Analyse fortgesetzt werden. Falls nicht, muss nach der Ursache für die Ungenauigkeit gesucht und entsprechende Abhilfe geschaffen werden.
11. Leistungsmerkmale der Methode (Präzision)
Statistische Ergebnisse des Ringversuchs: In den nachstehenden Tabellen sind die Werte für folgende Verbindungen zusammengefasst:
Ethanal, Ethylazetat, Azetal, Gesamtethanal, Methanol, Butanol-2, Propanol-1, Butanol-1, Methyl-2-Propanol-1, Methyl-2-Butanol-1, Methyl-3-Butanol-1.
Bei einem internationalen Ringversuch ergaben sich nach einem international abgestimmten Verfahren folgende Daten:
| Jahr des Ringversuchs | 1.997 |
| Anzahl Laboratorien | 32 |
| Anzahl Proben | 5 |
| Analyt | Ethanal |
| Proben | A | B | C | D | E |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 28 | 26 | 27 | 27 | 28 |
| Anzahl Ausreißer (Laboratorien) | 2 | 4 | 3 | 3 | 2 |
| Anzahl berücksichtigter Ergebnisse | 56 | 52 | 54 | 54 | 56 |
Mittelwert µg/g µg/g |
63,4 | 71,67 | 130,4 | 38,4 13,8 * |
28,6 52,2 * |
| Wiederholstandardabweichung (sr) µg/g | 3,3 | 1,9 | 6,8 | 4,1 | 3,6 |
| Relative Wiederholstandardabweichung (RSDr) (%) | 5,2 | 2,6 | 5,2 | 15,8 | 8,9 |
| Wiederholgrenze (r) µg/g | 9,3 | 5,3 | 19,1 | 11,6 | 10,1 |
| Vergleichstandardabweichung (sR) µg/g | 12 | 14 | 22 | 6,8 | 8,9 |
| Relative Vergleichstandardabweichung (RSDR) (%) | 18,9 | 19,4 | 17,1 | 26,2 | 22,2 |
| Vergleichgrenze (R) µg/g | 33,5 | 38,9 | 62,4 | 19,1 | 25,1 |
| Art der Proben: a Brandy: Blindduplikate. B Kirsch: Blindduplikate. C Grappa: Blindduplikate. D Whisky: Splitwerte *. E Rum: Splitwerte *. |
|||||
| Jahr des Ringversuchs | 1.997 |
| Anzahl Laboratorien | 32 |
| Anzahl Proben | 5 |
| Analyte | Ethylazetat |
| Proben | A | B | C | D | E |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 24 | 24 | 25 | 24 | 24 |
| Anzahl Ausreißer (Laboratorien) | 2 | 2 | 1 | 2 | 2 |
| Anzahl berücksichtigter Ergebnisse | 48 | 48 | 50 | 48 | 48 |
Mittelwert in µg/g in µg/g |
96,8 | 1 046 | 120,3 | 112,5 91,8 * |
99,1 117,0 * |
| Wiederholstandardabweichung (sr) in µg/g | 2,2 | 15 | 2,6 | 2,1 | 2,6 |
| Relative Wiederholstandardabweichung (RSDr) (%) | 2,3 | 1,4 | 2,1 | 2,0 | 2,4 |
| Wiederholgrenze (r) in µg/g | 6,2 | 40,7 | 7,2 | 5,8 | 7,3 |
| Vergleichstandardabweichung (sR) in µg/g | 6,4 | 79 | 8,2 | 6,2 | 7,1 |
| Relative Vergleichstandardabweichung (RSDR) (%) | 6,6 | 7,6 | 6,8 | 6,2 | 6,6 |
| Vergleichgrenze (R) in µg/g | 17,9 | 221,9 | 22,9 | 17,5 | 20,0 |
| Art der Proben: a Brandy: Blindduplikate. B Kirsch: Blindduplikate. C Grappa: Blindduplikate. D Whisky: Splitwerte *. E Rum: Splitwerte *. |
|||||
| Jahr des Ringversuchs | 1.997 |
| Anzahl Laboratorien | 32 |
| Anzahl Proben | 5 |
| Analyt | Azetal |
| Proben | A | B | C | D | E |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 20 | 21 | 22 | 17 | 21 |
| Anzahl Ausreißer (Laboratorien) | 4 | 3 | 2 | 4 | 3 |
| Anzahl berücksichtigter Ergebnisse | 40 | 42 | 44 | 34 | 42 |
Mittelwert µg/g µg/g |
35,04 | 36,46 | 68,5 | 20,36 6,60 * |
15,1 28,3 * |
| Wiederholstandardabweichung (sr) in µg/g | 0,58 | 0,84 | 1,6 | 0,82 | 1,9 |
| Relative Wiederholstandardabweichung (RSDr) (%) | 1,7 | 2,3 | 2,3 | 6,1 | 8,7 |
| Wiederholgrenze (r) in µg/g | 1,6 | 2,4 | 4,4 | 2,3 | 5,3 |
| Vergleichstandardabweichung (sR) in µg/g | 4,2 | 4,4 | 8,9 | 1,4 | 3,1 |
| Relative Vergleichstandardabweichung (RSDR) (%) | 12,1 | 12,0 | 13,0 | 10,7 | 14,2 |
| Vergleichgrenze (R) in µg/g | 11,8 | 12,2 | 25,0 | 4,0 | 8,7 |
| Art der Proben: a Brandy: Blindduplikate. B Kirsch: Blindduplikate. C Grappa: Blindduplikate. D Whisky: Splitwerte *. E Rum: Splitwerte *. |
|||||
| Jahr des Ringversuchs | 1.997 |
| Anzahl Laboratorien | 32 |
| Anzahl Proben | 5 |
| Analyt | Gesamtethanal |
| Proben | A | B | C | D | E |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 23 | 19 | 22 | 21 | 22 |
| Anzahl Ausreißer (Laboratorien) | 1 | 5 | 2 | 3 | 2 |
| Anzahl berücksichtigter Ergebnisse | 46 | 38 | 44 | 42 | 44 |
Mittelwert in µg/g in µg/g |
76,5 | 85,3 | 156,5 | 45,4 15,8 * |
32,7 61,8 * |
| Wiederholstandardabweichung (sr) in µg/g | 3,5 | 1,3 | 6,5 | 4,4 | 3,6 |
| Relative Wiederholstandardabweichung (RSDr) (%) | 4,6 | 1,5 | 4,2 | 14,2 | 7,6 |
| Wiederholgrenze (r) in µg/g | 9,8 | 3,5 | 18,3 | 12,2 | 10,0 |
| Vergleichstandardabweichung (sR) in µg/g | 13 | 15 | 24,1 | 7,3 | 9,0 |
| Relative Vergleichstandardabweichung (RSDR) (%) | 16,4 | 17,5 | 15,4 | 23,7 | 19,1 |
| Vergleichgrenze (R) in µg/g | 35,2 | 41,8 | 67,4 | 20,3 | 25,2 |
| Art der Proben: a Brandy: Blindduplikate. B Kirsch: Blindduplikate. C Grappa: Blindduplikate. D Whisky: Splitwerte *. E Rum: Splitwerte *. |
|||||
| Jahr des Ringversuchs | 1.997 |
| Anzahl Laboratorien | 32 |
| Anzahl Proben | 5 |
| Analyt | Methanol |
| Proben | A | B | C | D | E |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 26 | 27 | 27 | 28 | 25 |
| Anzahl Ausreißer (Laboratorien) | 4 | 3 | 3 | 1 | 4 |
| Anzahl berücksichtigter Ergebnisse | 52 | 54 | 54 | 56 | 50 |
Mittelwert in µg/g in µg/g |
319,8 | 2.245 | 1.326 | 83,0 61,5 * |
18,6 28,9 * |
| Wiederholstandardabweichung (sr) in µg/g | 4,4 | 27 | 22 | 1,5 | 1,3 |
| Relative Wiederholstandardabweichung (RSDr) (%) | 1,4 | 1,2 | 1,7 | 2,1 | 5,6 |
| Wiederholgrenze (r) in µg/g | 12,3 | 74,4 | 62,5 | 4,3 | 3,8 |
| Vergleichstandardabweichung (sR) in µg/g | 13 | 99 | 60 | 4,5 | 2,8 |
| Relative Vergleichstandardabweichung (RSDR) (%) | 3,9 | 4,4 | 4,6 | 6,2 | 11,8 |
| Vergleichgrenze (R) in µg/g | 35,2 | 278,3 | 169,1 | 12,5 | 7,9 |
| Art der Proben: a Brandy: Blindduplikate. B Kirsch: Blindduplikate. C Grappa: Blindduplikate. D Whisky: Splitwerte *. E Rum: Splitwerte *. |
|||||
| Jahr des Ringversuchs | 1.997 |
| Anzahl Laboratorien | 32 |
| Anzahl Proben | 4 |
| Analyt | Butanol-2 |
| Proben | A | B | C | E |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 21 | 27 | 29 | 22 |
| Anzahl Ausreißer (Laboratorien) | 4 | 3 | 1 | 3 |
| Anzahl berücksichtigter Ergebnisse | 42 | 54 | 58 | 44 |
Mittelwert in µg/g in µg/g |
5,88 | 250,2 | 27,57 | 5,83 14,12 * |
| Wiederholstandardabweichung (sr) in µg/g | 0,40 | 2,2 | 0,87 | 0,64 |
| Relative Wiederholstandardabweichung (RSDr) (%) | 6,8 | 0,9 | 3,2 | 6,4 |
| Wiederholgrenze (r) in µg/g | 1,1 | 6,1 | 2,5 | 1,8 |
| Vergleichstandardabweichung (sR) in µg/g | 0,89 | 13 | 3,2 | 0,87 |
| Relative Vergleichstandardabweichung (RSDR) (%) | 15,2 | 5,1 | 11,5 | 8,7 |
| Vergleichgrenze (R) in µg/g | 2,5 | 35,5 | 8,9 | 2,4 |
| Art der Proben: a Brandy: Blindduplikate. B Kirsch: Blindduplikate. C Grappa: Blindduplikate. D Rum: Splitwerte *. |
||||
| Jahr des Ringversuchs | 1.997 |
| Anzahl Laboratorien | 32 |
| Anzahl Proben | 5 |
| Analyt | Propanol-1 |
| Proben | A | B | C | D | E |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 29 | 27 | 27 | 29 | 29 |
| Anzahl Ausreißer (Laboratorien) | 2 | 4 | 3 | 2 | 2 |
| Anzahl berücksichtigter Ergebnisse | 58 | 54 | 54 | 58 | 58 |
Mittelwert in µg/g in µg/g |
86,4 | 3 541 | 159,1 | 272,1 229,3 * |
177,1 222,1 * |
| Wiederholstandardabweichung (sr) in µg/g | 3,0 | 24 | 3,6 | 2,3 | 3,3 |
| Relative Wiederholstandardabweichung (RSDr) (%) | 3,4 | 0,7 | 2,3 | 0,9 | 1,6 |
| Wiederholgrenze (r) in µg/g | 8,3 | 68,5 | 10,0 | 6,4 | 9,1 |
| Vergleichstandardabweichung (sR) in µg/g | 5,3 | 150 | 6,5 | 9,0 | 8,1 |
| Relative Vergleichstandardabweichung (RSDR) (%) | 6,1 | 4,1 | 4,1 | 3,6 | 4,1 |
| Vergleichgrenze (R) in µg/g | 14,8 | 407,2 | 18,2 | 25,2 | 22,7 |
| Art der Proben: a Brandy: Blindduplikate. B Kirsch: Blindduplikate. C Grappa: Blindduplikate. D Whisky: Splitwerte *. E Rum: Splitwerte *. |
|||||
| Jahr des Ringversuchs | 1.997 |
| Anzahl Laboratorien | 32 |
| Anzahl Proben | 3 |
| Analyt | Butanol-1 |
| Proben | A | B | C |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 20 | 22 | 22 |
| Anzahl Ausreißer (Laboratorien) | 4 | 4 | 6 |
| Anzahl berücksichtigter Ergebnisse | 40 | 44 | 44 |
Mittelwert in µg/g in µg/g |
3,79 | 5,57 | 7,54 |
| Wiederholstandardabweichung (sr) in µg/g | 0,43 | 0,20 | 0,43 |
| Relative Wiederholstandardabweichung (RSDr) (%) | 11,2 | 3,6 | 5,6 |
| Wiederholgrenze (r) in µg/g | 1,1 | 0,6 | 1,2 |
| Vergleichstandardabweichung (sR) in µg/g | 0,59 | 0,55 | 0,82 |
| Relative Vergleichstandardabweichung (RSDR) (%) | 15,7 | 9,8 | 10,8 |
| Vergleichgrenze (R) in µg/g | 1,7 | 1,5 | 2,3 |
| Art der Proben: a Brandy: Blindduplikate. B Kirsch: Blindduplikate. C Grappa: Blindduplikate. |
|||
| Jahr des Ringversuchs | 1.997 |
| Anzahl Laboratorien | 32 |
| Anzahl Proben | 53 |
| Analyt | Methyl-2-Propanol-1 |
| Proben | A | B | C | D | E |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 28 | 31 | 30 | 26 | 25 |
| Anzahl Ausreißer (Laboratorien) | 3 | 0 | 1 | 5 | 6 |
| Anzahl berücksichtigter Ergebnisse | 56 | 62 | 60 | 52 | 50 |
Mittelwert in µg/g in µg/g |
174,2 | 111,7 | 185,0 | 291,0 246,8 * |
115,99 133,87 * |
| Wiederholstandardabweichung (sr) in µg/g | 2,3 | 1,6 | 2,5 | 1,8 | 0,74 |
| Relative Wiederholstandardabweichung (RSDr) (%) | 1,3 | 1,4 | 1,3 | 0,7 | 0,6 |
| Wiederholgrenze (r) in µg/g | 6,4 | 4,5 | 6,9 | 5,0 | 2,1 |
| Vergleichstandardabweichung (sR) in µg/g | 8,9 | 8,9 | 9,7 | 6,0 | 6,2 |
| Relative Vergleichstandardabweichung (RSDR) (%) | 5,1 | 8,0 | 5,2 | 2,2 | 5,0 |
| Vergleichgrenze (R) in µg/g | 24,9 | 24,9 | 27,2 | 16,9 | 17,4 |
| Art der Proben: a Brandy: Blindduplikate. B Kirsch: Blindduplikate. C Grappa: Blindduplikate. D Whisky: Splitwerte *. E Rum: Splitwerte *. |
|||||
| Jahr des Ringversuchs | 1.997 |
| Anzahl Laboratorien | 32 |
| Anzahl Proben | 5 |
| Analyt | Methyl-2-Butanol-1 |
| Proben | A | B | C | D | E |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 25 | 26 | 25 | 27 | 25 |
| Anzahl Ausreißer (Laboratorien) | 3 | 2 | 3 | 1 | 2 |
| Anzahl berücksichtigter Ergebnisse | 50 | 52 | 50 | 54 | 50 |
Mittelwert µg/g µg/g |
113,0 | 48,3 | 91,6 | 72,1 45,2 * |
39,5 61,5 * |
| Wiederholstandardabweichung (sr) in µg/g | 2,1 | 1,5 | 1,7 | 2,3 | 2,3 |
| Relative Wiederholstandardabweichung (RSDr) (%) | 1,9 | 3,1 | 1,8 | 3,9 | 4,5 |
| Wiederholgrenze (r) in µg/g | 6,0 | 4,2 | 4,7 | 6,4 | 6,3 |
| Vergleichstandardabweichung (sR) in µg/g | 7,4 | 3,8 | 6,6 | 4,7 | 4,5 |
| Relative Vergleichstandardabweichung (RSDR) (%) | 6,6 | 7,9 | 7,2 | 8,1 | 8,8 |
| Vergleichgrenze (R) in µg/g | 20,8 | 10,7 | 18,4 | 13,3 | 12,5 |
| Art der Proben: a Brandy: Blindduplikate. B Kirsch: Blindduplikate. C Grappa: Blindduplikate. D Whisky: Splitwerte *. E Rum: Splitwerte *. |
|||||
| Jahr des Ringversuchs | 1.997 |
| Anzahl Laboratorien | 32 |
| Anzahl Proben | 5 |
| Analyt | Methyl-3-Butanol-1 |
| Proben | A | B | C | D | E |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 23 | 23 | 24 | 27 | 21 |
| Anzahl Ausreißer (Laboratorien) | 5 | 5 | 4 | 1 | 6 |
| Anzahl berücksichtigter Ergebnisse | 46 | 46 | 48 | 54 | 42 |
Mittelwert in µg/g µ in µg/g µ |
459,4 | 242,7 | 288,4 | 142,2 120,4 * |
212,3 245,6 * |
| Wiederholstandardabweichung (sr) in µg/g | 5,0 | 2,4 | 3,4 | 2,4 | 3,2 |
| Relative Wiederholstandardabweichung (RSDr) (%) | 1,1 | 1,0 | 1,2 | 1,8 | 1,4 |
| Wiederholgrenze (r) in µg/g | 13,9 | 6,6 | 9,6 | 6,6 | 9,1 |
| Vergleichstandardabweichung (sR) in µg/g | 29,8 | 13 | 21 | 8,5 | 6,7 |
| Relative Vergleichstandardabweichung (RSDR) (%) | 6,5 | 5,2 | 7,3 | 6,5 | 2,9 |
| Vergleichgrenze (R) in µg/g | 83,4 | 35,4 | 58,8 | 23,8 | 18,7 |
| Art der Proben: a Brandy: Blindduplikate. B Kirsch: Blindduplikate. C Grappa: Blindduplikate. D Whisky: Splitwerte *. E Rum: Splitwerte *. |
|||||
III.3. Bestimmung flüchtiger Säure in Spirituosen16
1. Anwendungsbereich
Die Methode wurde durch einen Ringversuch für Rum, Brandy, Obstbrände und Obsttrester bei Konzentrationen von 30 mg/l bis 641 mg/l validiert.
2. Normen
ISO 3696:1987 Wasser für Analysezwecke - Spezifikationen und Testverfahren.
3. Definitionen
3.1. Die flüchtige Säure wird berechnet durch Subtraktion der nichtflüchtigen Säure von der Gesamtsäure.
3.2. Die Gesamtsäure entspricht der Summe der titrierbaren Säuren.
3.3. Der Gehalt an nichtflüchtigen Säuren entspricht dem Säuregehalt des Verdampfungsrückstands der Spirituose.
4. Prinzip
Gesamtsäure und nichtflüchtige Säure werden durch Titration oder Potentiometrie bestimmt.
5. Reagenzien und Material
Falls nichts anderes angegeben ist, sind für die Analyse nur Reagenzien von anerkannter Analysequalität und Wasser, das mindestens der Kategorie 3 gemäß den Begriffsbestimmungen nach ISO 3696:1987 entspricht, zu verwenden.
5.1. Natriumhydroxidlösung (NaOH), 0,01 M.
5.2. Mischindikatorlösung:
0,1 g Indigocarmin und 0,1 g Phenolrot abwiegen.
In 40 ml Wasser auflösen und mit Ethanol auf 100 ml auffüllen.
6. Gerät und Ausrüstung
Indirekte Laborapparatur, Volumenmessgeräte aus Glas der Kategorie a und Folgendes:
6.1. Wasserpumpe
6.2. Rotationsverdampfer oder Ultraschallwanne
6.3. Geräte für die potentiometrische Titration (fakultativ)
7. Probenahmen und Proben
Die Proben werden vor der Analyse bei Raumtemperatur gelagert.
8. Verfahren
8.1. Gesamtsäure
8.1.1. Vorbereitung der Probe
Falls erforderlich, wird die Spirituose zur Beseitigung des Kohlendioxids mindestens zwei Minuten lang unter Vakuum gerührt, oder das Kohlendioxid wird durch Ultraschallbestrahlung entfernt.
8.1.2. Titration
25 ml der Spirituose in einen 500-ml-Erlenmeyerkolben pipettieren.
Etwa 200 ml abgekühltes, abgekochtes destilliertes Wasser (täglich frisch zubereitet) sowie 2 bis 6 Tropfen der Mischindikatorlösung ( 5.2) zugeben.
Mit der 0,01 M Natriumhydroxidlösung ( 5.1) bis zum Farbumschlag von Gelb-Grün nach Violett bei farblosen Spirituosen bzw. von Gelb-Braun zu Rot-Braun bei braunen Spirituosen titrieren.
Es kann ebenfalls eine potentiometrische Titration bei pH 7,5 vorgenommen werden.
Das Volumen in ml an Natronlauge 0,01 M, das hinzugefügt wurde, wird als n1 bezeichnet.
8.1.3. Berechnung
Die Gesamtsäure (TA), ausgedrückt in Milliäquivalenten je Liter Spirituose, entspricht 0,4 x n1.
Die Gesamtsäure (TA'), ausgedrückt in mg Essigsäure je Liter Spirituose, entspricht 24 x n1.
8.2. Gebundene Säure
8.2.1. Vorbereitung der Probe
25 ml der Spirituose zur Trockne eindampfen:
25 ml der Spirituose in eine zylindrische Abdampfschale mit Flachboden und 55 mm Durchmesser pipettieren. Während der ersten Stunde des Verdampfungsvorgangs wird die Abdampfschale auf den Deckel eines siedenden Wasserbades gestellt, sodass die Flüssigkeit selbst nicht siedet, denn dies könnte zu Verlusten durch Verspritzen führen.
Der Trockenvorgang wird abgeschlossen, indem die Abdampfschale für zwei Stunden bei 105 °C in einen Trockenschrank gestellt wird. Die Abdampfschale in einem Exsikkator abkühlen lassen.
8.2.2. Titration
Den Verdampfungsrückstand in abgekühltem, abgekochtem destilliertem Wasser (täglich frisch zubereitet) auflösen und auf etwa 100 ml auffüllen; 2 bis 6 Tropfen der Mischindikatorlösung ( 5.2) zugeben.
Mit der 0,01 M Natriumhydroxidlösung ( 5.1) titrieren.
Es kann ebenfalls eine potentiometrische Titration bei pH 7,5 vorgenommen werden.
Das Volumen in ml an Natronlauge 0,01 M, das hinzugefügt wurde, wird als n2 bezeichnet.
8.2.3. Berechnung
Die nichtflüchtige Säure (FA), ausgedrückt in Milliäquivalenten je Liter Spirituose, entspricht 0,4 x n2.
Die nichtflüchtige Säure (FA), ausgedrückt in mg Essigsäure je Liter Spirituose, entspricht 24 x n2.
9. Berechnung des Gehalts an flüchtigen Säuren
9.1. Angabe in Milliäquivalenten je Liter:
Ta = Gesamtsäuregrad in Milliäquivalenten je Liter
Fa = Gehalt an nichtflüchtigen Säure in Milliäquivalenten je Liter
Der Gehalt an flüchtigen Säuren, VA, in Milliäquivalenten je Liter entspricht:
Ta - FA
9.2. Angabe in mg Essigsäure je Liter:
TA' = Gesamtsäure in mg Essigsäure je Liter
FA' = nichtflüchtige Säure in mg Essigsäure je Liter
Flüchtige Säure, VA, in mg Essigsäure je Liter entspricht:
TA' - FA'
9.3. Angabe in g Essigsäure je hl reiner Alkohol 100 Vol.- %:
[(TA' - FA') / A] x 10
Dabei entspricht a dem volumetrischen Alkoholgehalt der Spirituose.
10. Leistungsmerkmale der Methode (Präzision)
10.1. Statistische Ergebnisse des Ringversuchs
Bei einem internationalen Ringversuch ergaben sich nach einem international abgestimmten Verfahren [1] [2] folgende Daten:
| Jahr des Ringversuchs | 2000 |
| Anzahl der teilnehmenden Laboratorien | 18 |
| Anzahl der Proben | 6 |
| Proben | A | B | C | D | E | F |
| Anzahl der Laboratorien ohne Ausreißer | 16 | 18 | 18 | 14 | 18 | 18 |
| Anzahl der Ausreißer (Laboratorien) | 2 | 4 | ||||
| Anzahl der berücksichtigten Ergebnisse | 32 | 36 | 36 | 28 | 36 | 36 |
Mittelwert [mg/l] [mg/l] |
272* 241* |
30 | 591* 641* |
46 | 107 | 492 |
| Wiederholstandardabweichung sr [mg/l] | 8,0 | 3,6 | 15,0 | 3,7 | 6,7 | 8,5 |
| Wiederholbarkeit relative Standardabweichung, RSDr [%] | 3,1 | 11,8 | 2,4 | 8,0 | 6,2 | 1,7 |
| Wiederholgrenze r [mg/l] | 23 | 10 | 42 | 10 | 19 | 24 |
| Vergleichstandardabweichung sR [mg/l] | 8,5 | 8,4 | 25,0 | 4,55 | 13,4 | 24,4 |
| Relative Vergleichstandardabweichung, RSDR [%] | 3,3 | 27,8 | 4,1 | 9,9 | 12,5 | 5,0 |
| Vergleichgrenze, R [mg/l] | 24 | 23 | 70 | 13 | 38 | 68 |
Art der Proben:
a Pflaumenbranntwein; Splitwert*
B Rum I; Blindduplikate
C Rum II; Splitwert*
D Sliwowitz; Blindduplikate
E Brandy; Blindduplikate
F Tresterbrand; Blindduplikate
[1] 'Protocol for the Design, Conduct and Interpretation of Method- Performance Studies', Horwitz, W. (1995) Pure and Applied Chemistry 67, 332-343.
[2] Horwitz, W. (1982) 'Analytical Chemistry 54, 67A-76A'.
V. Anethol. Bestimmung von Trans-Anethol in Spirituosen durch Gaschromatographie
1. Anwendungsbereich
Diese Methode eignet sich für die Bestimmung von trans-Anethol in Spirituosen mit Anis durch Kapillar-Gaschromatographie.
2. Normen
ISO 3696: 1987 Wasser für analytische Laborzwecke - Spezifikation und Prüfverfahren.
3. Prinzip
Die trans-Anethol-Konzentration von Spirituosen wird durch Gaschromatographie (GC) bestimmt. Die gleiche Menge eines internen Standards, z.B. 4-Allylanisol (Estragol), wird der Probe und einer trans-Anethol-Referenzlösung mit bekannter Konzentration zugegeben, wenn Estragol nicht natürlicherweise in der zu untersuchenden Probe vorhanden ist; beide werden mit einer 45%igen Ethanollösung verdünnt und direkt in das GC-System eingespritzt. Bei Likören mit hohem Zuckergehalt muss vor der Probenvorbereitung und Analyse eine Extraktion vorgenommen werden.
4. Reagenzien und Material
Bei der Analyse sind ausschließlich Reagenzien mit einer Reinheit von mindestens 98 % zu verwenden. Es sollte Wasser von mindestens Grad 3 gemäß ISO 3696 verwendet werden.
Referenzsubstanzen sollten gekühlt (4 °C) und lichtgeschützt in Aluminiumbehältern oder in Braunglas-Standflaschen aufbewahrt werden. Die Stopfen sollten mit einer Aluminiumdichtung versehen sein. Trans-Anethol muss vor der Verwendung aus seinem kristallinen Zustand "aufgetaut" werden, dabei darf die Temperatur aber nie 35 °C übersteigen.
4.1. Ethanol 96 % vol. (CAS 64-17-5)
4.2. 1-Methoxy-4-(1-propenyl)benzol; (trans-Anethol) (CAS 4180-23-8)
4.3 4-Allylanisol, (Estragol) (CAS 140-67-0), empfohlener interner Standard (IS)
4.4. Ethanol 45 % vol.
560 g destilliertes Wasser zu 378 g Ethanol 96 % vol. zugeben.
4.5. Zubereitung von Standardlösungen
Alle Standardlösungen sind bei Zimmertemperatur (15-35 °C) und lichtgeschützt in Aluminiumbehältern oder in Braunglas-Standflaschen aufzubewahren. Der Stopfen sollte mit einer Aluminiumdichtung versehen sein.
Da trans-Anethol und 4-Allylanisol in Wasser praktisch unlöslich sind, müssen sie vor der Zugabe von 45%igem Ethanol in etwas 96%igem Ethanol ( 4.1) gelöst werden.
Die Stammlösungen sind jede Woche frisch anzusetzen.
4.5.1. Standardlösung A
Trans-Anetholstammlösung (Konzentration: 2 g/l):
40 mg trans-Anethol ( 4.2) in einem 20-ml-Messkolben einwiegen (oder 400 mg in 200 ml usw.). Etwas 96%iges Ethanol ( 4.1) zugeben und mit 45%igem Ethanol ( 4.4) zur Marke auffüllen, gründlich mischen.
4.5.2. Interne Standardlösung B
Stammlösung des internen Standards, z.B. Estragol (Konzentration: 2 g/l) 40 mg Estragol ( 4.3) in einem 20-ml-Messkolben einwiegen (oder 400 mg in 200 ml usw.). Etwas 96%iges Ethanol ( 4.1) zugeben und mit 45%igem Ethanol ( 4.4) zur Marke auffüllen, gründlich mischen.
4.5.3. Lösungen zur Überprüfung der Linearreaktion des FID
Die Linearreaktion des FID muss für die Analyse bei verschiedenen Konzentrationen von trans-Anethol in Spirituosen (0 bis 2,5 g/l) überprüft werden. Im Analyseverlauf werden die zu analysierenden Blindproben der Spirituosen 10-fach verdünnt. Für die in der Methode beschriebenen Analysebedingungen werden Stammlösungen mit Konzentrationen von 0,05, 0,1, 0,15, 0,2 und 0,25 g/l trans-Anethol in der zu analysierenden Probe wie folgt zubereitet: 0,5, 1, 1,5, 2 und 2,5 ml der Stammlösung a ( 4.5.1) in einzelne 20-ml-Messkolben pipettieren; in jeden Kolben 2 ml der internen Standardlösung B ( 4.5.2) zugeben und mit Ethanol 45 % vol. ( 4.4) zur Marke auffüllen, gründlich mischen.
Als 0 g/l-Lösung wird die Blindlösung ( 8.4) verwendet.
4.5.4. Standardlösung C
2 ml Standardlösung a ( 4.5.1) in einen 20-ml-Messkolben pipettieren, 2 ml interne Standardlösung B ( 4.5.2) zugeben und mit 45%igem Ethanol ( 4.4) zur Marke auffüllen, gründlich mischen.
5. Geräte und Ausrüstung
5.1. Kapillar-Gaschromatograph mit Flammenionisationsdetektor (FID) und Integrator oder anderem Datenverarbeitungssystem, das Peakhöhen oder -flächen messen kann, sowie mit automatischen Probenaufgabesystem oder der erforderlichen Ausrüstung für manuelle Probeneinspritzung.
5.2. Split/splitless-Injektor
5.3. Kapillarsäule, z.B.:
Länge: 50 m,
Innendurchmesser: 0,32 mm,
Schichtdicke: 0,2 µm,
Stationäre Phase: FFAP - modifiziertes TPa Polyethylenglykol vernetztes poröses Polymer.
5.4. Übliche Laborausrüstung: Glaslaborgeräte, Genauigkeitsklasse A, Analysenwaage (Genauigkeit: ± 0,1 mg).
6. Chromatographiebedingungen
Die Art und Größe der Säule sowie die GC-Bedingungen sollten so gewählt werden, das Anethol und der interne Standard voneinander und von allen Störsubstanzen getrennt werden. Typische Bedingungen für die unter Nummer 5.3 als Beispiel angeführte Säule sind:
6.1. Trägergas: Helium, Analysenqualität
6.2. Strömungsgeschwindigkeit: 2 ml/min
6.3. Injektortemperatur: 250 °C
6.4. Detektortemperatur: 250 °C
6.5. Ofentemperatur: isotherm, 180 °C, Laufzeit 10 Minuten
6.6. Einspritzvolumen: 1 µl, Split: 1:40
7. Proben
Proben sollten bei Zimmertemperatur und lichtgeschützt aufbewahrt werden.
8. Ausführung
8.1. Untersuchung der Probe auf Estragol
Um sicherzustellen, dass die Probe kein natürliches Estragol enthält, sollte eine Blindprobe ohne Zugabe eines internen Standards analysiert werden. Wenn die Probe natürliches Estragol enthält, ist ein anderer interner Standard zu verwenden (z.B. Methanol).
2 ml der Probe werden in einen 20-ml-Messkolben pipettiert, mit Ethanol 45 % vol. ( 4.4) zur Marke aufgefüllt und gründlich gemischt.
8.2. Zubereitung unbekannter Proben
2 ml der Probe werden in einen 20-ml-Messkolben pipettiert, 2 ml interne Standardlösung B ( 4.5.2) zugegeben, mit 45%igem Ethanol ( 4.4) zur Marke aufgefüllt und gründlich gemischt.
8.3. Blindlösung
2 ml interne Standardlösung B ( 4.5.2) werden in einen 20-ml-Messkolben pipettiert, mit 45%igem Ethanol ( 4.4) zur Marke aufgefüllt und gründlich gemischt.
8.4. Linearitätsprüfung
Vor Beginn der Analyse sollte die Linearität des FID überprüft werden, indem jede der Linearitätsstandardlösungen ( 4.5.3) dreimal hintereinander analysiert wird.
Auf der Grundlage der Integrator-Peakflächen oder Peakhöhen für jede Injektion wird ein Graph ihrer Mutterlösungskonzentration in g/l gegen das Verhältnis R für jede Lösung aufgezeichnet.
R = trans-Anethol-Peakhöhe oder -fläche dividiert durch die Estragol-Peakhöhe oder -fläche.
Dabei sollte sich eine lineare Kurve ergeben.
8.5. Bestimmung
Die Blindlösung ( 8.3) wird eingespritzt, darauf die Standardlösung C ( 4.5.4) und darauf einer der Linearitätsstandards ( 4.5.3), der als Qualitätskontrollprobe fungieren wird (diese kann unter Berücksichtigung der wahrscheinlichen Konzentration von trans-Anethol in der unbekannten Probe gewählt werden), darauf folgen fünf unbekannte Probenlösungen ( 8.2). Zur Gewährleistung der analytischen Stabilität ist nach jeweils fünf unbekannten Probenlösungen eine Linearitätsprobe (Qualitätskontrolle) einzufügen.
9. Berechnung des Reaktionsfaktors
Die Peakflächen (mit einem Integrator oder einem anderen Datenverarbeitungssystem) oder die Peakhöhen (manuelle Integration) für Peaks von trans-Anethol und internem Standard werden gemessen.
9.1. Berechnung des Reaktionsfaktors (RFi)
Der Reaktionsfaktor wird wie folgt berechnet:
RFi = (Ci/Fläche oder Höhei)*(Fläche oder Höhe is/Cis)
Dabei ist:
Ci die trans-Anethol-Konzentration in der Standardlösung a ( 4.5.1)
Cis die Konzentration des internen Standards in der Standardlösung B ( 4.5.2)
Flächei die Fläche (oder Höhe) des trans-Anethol-Peaks
Flächeis die Fläche (oder Höhe) des internen Standard-Peaks
RFi wird auf der Grundlage der fünf Proben von Lösung C ( 4.5.4) berechnet.
9.2. Analyse der Linearitätsprüflösungen
Die Linearitätsprüflösungen ( 4.5.3) werden eingespritzt.
9.3. Analyse der Probe
Die Lösung der unbekannten Probe ( 8.2) wird eingespritzt.
10. Berechnung der Ergebnisse
Die trans-Anethol-Konzentration wird nach folgender Formel berechnet:
Ci = Cis*(Fläche oder Höhei/Fläche oder Höheis)*Rfi
Dabei ist:
ci die unbekannte trans-Anethol-Konzentration
Cis (4.5.2) die Konzentration des internen Standards in der unbekannten Probe ( 4.5.2)
Fläche oder Höhei die Fläche oder Höhe des trans-Anethol-Peaks
Fläche oder Höheis die Fläche oder Höhe des internen Standard-Peaks
RFi der (gemäß Nummer 9.1 berechnete) Reaktionskoeffizient
Die trans-Anethol-Konzentration wird mit einer Dezimalstelle in Gramm pro Liter ausgedrückt.
11. Qualitätssicherung und -kontrolle
Die Chromatogramme sollten so ausfallen, dass Anethol und der interne Standard voneinander und von allen Störsubstanzen getrennt sind. Der RFi-Wert wird auf der Grundlage der Ergebnisse der fünf Injektionen von Lösung C ( 4.5.4) berechnet. Liegt der Variationskoeffizient (CV % = (Standardabweichung/Mittelwert)*100)) innerhalb von +/- 1 %, so kann der RFi-Durchschnittswert akzeptiert werden.
Die obige Berechnung sollte zur Berechnung der Konzentration von trans-Anethol in der Probe verwendet werden, die für die Qualitätskontrolle auf der Grundlage der Linearitätskontrolllösungen ( 4.5.3) gewählt wurde.
Liegen die durchschnittlichen berechneten Ergebnisse aus der Analyse der Linearitätslösung, die als interne Qualitätskontrollprobe (IQC) gewählt wurde, in einer Bandbreite zwischen +/- 2,5 % um ihren theoretischen Wert, so können die Ergebnisse für die unbekannten Proben akzeptiert werden.
12. Behandlung einer Spirituosenprobe mit hohem Zuckergehalt und einer Likörprobe vor der GC-Analyse
Extraktion von Alkohol aus einer Spirituose mit hohem Zuckergehalt, um die trans-Anethol-Konzentration durch Kapillar-Gaschromatographie bestimmen zu können.
12.1. Prinzip
Einer aliquoten Menge der Likörprobe wird der interne Standard in einer Konzentration zugesetzt, die mit der des Analyten (trans-Anethol) im Likör vergleichbar ist. Dann werden Natriumphosphat Dodecahydrat und wasserfreies Ammoniumsulfat zugegeben. Die Mischung wird gründlich geschüttelt und gekühlt, wobei sich zwei Schichten bilden; die obere Alkoholschicht wird entfernt. Eine aliquote Menge dieser Alkoholschicht wird mit 45%iger Ethanollösung ( 4.4) verdünnt (Hinweis: Zu diesem Zeitpunkt wird kein interner Standard zugegeben, da er bereits zugegeben wurde). Die Lösung wird durch Gaschromatographie analysiert.
12.2. Reagenzien und Material
Bei der Extraktion sind nur Reagenzien mit einer Reinheit von mehr als 99 % zu verwenden.
12.2.1. Ammoniumsulfat, wasserfrei, (CAS 7783-20-2)
12.2.2. Natriumphosphat, zweibasisch, Dodecahydrat, (CAS 10039-32-4)
12.3. Geräte und Ausrüstung
Erlenmeyerkolben, Trennkolben, Kühlschrank.
12.4. Verfahren
12.4.1. Untersuchung der Probe auf Estragol
Um sicherzustellen, dass die Probe kein natürliches Estragol enthält, sollte eine Blindextraktion (12.6.2) und Analyse ohne Zugabe eines internen Standards durchgeführt werden. Wenn die Probe natürliches Estragol enthält, ist ein anderer interner Standard zu verwenden.
12.4.2. Extraktion
5 ml des 96%igen Ethanols ( 4.1) werden in einen Erlenmeyerkolben pipettiert; in diesen Kolben werden 50 mg des internen Standards ( 4.3) eingewogen, und 50 ml der Probe werden zugegeben. 12 g Ammoniumsulfat, wasserfrei ( 12.2.1) und 8,6 g zweibasisches Natriumphosphat, Dodecahydrat ( 12.2.2) zugeben. Den Erlenmeyerkolben verschließen.
Der Kolben wird mindestens 30 Minuten lang geschüttelt. Eine mechanische Schüttelvorrichtung kann verwendet werden, aber keine teflonbeschichteten Magnetrührer, da das Teflon einen Teil des Analyten absorbieren würde. Zugegebene Salze werden nicht vollständig gelöst.
Der mit Stopfen verschlossene Kolben wird mindestens zwei Stunden in einen Kühlschrank (T < 5 °C) gestellt.
Nach Ablauf dieser Zeit sollten sich zwei getrennte Flüssigkeitsschichten und ein fester Rückstand zeigen. Die Alkoholschicht sollte klar sein; ist dies nicht der Fall, wird der Kolben wieder in den Kühlschrank gestellt, bis eine klare Trennung erreicht ist.
Wenn die Alkoholschicht klar ist, wird - ohne die wässrige Schicht zu stören - vorsichtig eine aliquote Menge (z.B. 10 ml) entnommen und in eine Braunglasampulle überführt. Die Ampulle wird fest verschlossen.
12.4.3. Vorbereitung der zu analysierenden extrahierten Probe
Den Extrakt ( 12.4.2) Zimmertemperatur erreichen lassen.
2 ml der Alkoholschicht der extrahierten Probe in einen 20-ml-Messkolben pipettieren, mit 45%igem Ethanol ( 4.4) zur Marke auffüllen und gründlich mischen.
12.5. Bestimmung
Das Verfahren gemäß Nummer 8.5 durchführen.
12.6. Berechnung der Ergebnisse
Die Ergebnisse werden nach folgender Formel berechnet:
Ci = (mis/V)*(Flächei/Flächeis)*Rfi
Dabei ist:
mis das Gewicht des verwendeten ( 12.4.2) internen Standards ( 4.3) (in mg)
V das Volumen der unbekannten Probe (50 ml)
RFi der Reaktionsfaktor ( 9.1.)
Flächei die Fläche des trans-Anethol-Peaks
Flächeis die Fläche des internen Standard-Peaks
Die Ergebnisse werden mit einer Dezimalstelle in Gramm pro Liter ausgedrückt.
12.7. Qualitätssicherung und -kontrolle
Das Verfahren gemäß Nummer 11 durchführen.
13. Leistungsmerkmale der Methode (Präzision)
Statistische Ergebnisse des Ringversuchs:
In den nachstehenden Tabellen sind die Werte für Anethol zusammengefasst.
Bei einem internationalen Ringversuch ergaben sich nach einem international abgestimmten Verfahren:
| Jahr der Ringversuchs | 1998 |
| Anzahl Laboratorien | 16 |
| Anzahl Proben | 10 |
| Analyt | Anethol |
| Proben | A | B | C | D | E | F |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 15 | 15 | 15 | 13 | 16 | 16 |
| Anzahl Ausreißer (Laboratorien) | 1 | 1 | 1 | 3 | - | - |
| Anzahl berücksichtigter Ergebnisse | 30 | 30 | 30 | 26 | 16 | 16 |
| Mittelwert g/l | 1,477 | 1,955 | 1,940 | 1,833 | 1,741 | 1,754 |
| Wiederholstandardabweichung (Sr) g/l | 0,022 | 0,033 | 0,034 | 0,017 | - | - |
| Relative Wiederholstandardabweichung (RSDr) (%) | 1,5 | 1,7 | 1,8 | 0,9 | - | - |
| Wiederholgrenze (r) g/l | 0,062 | 0,093 | 0,096 | 0,047 | - | - |
| Vergleichstandardabweichung (SR) g/l | 0,034 | 0,045 | 0,063 | 0,037 | 0,058 | 0,042 |
| Relative Vergleichstandardabweichung (RSDR) (%) | 2,3 | 2,3 | 3,2 | 2,0 | 3,3 | 2,4 |
| Vergleichgrenze (R) g/l | 0,094 | 0,125 | 0,176 | 0,103 | 0,163 | 0,119 |
Art der Proben:
a Pastis, Blindduplikate
B Pastis, Blindduplikate
C Pastis, Blindduplikate
D Pastis, Blindduplikate
E Pastis, Einzelprobe
F Pastis, Einzelprobe
Andere Spirituosen mit Anis:
| Proben | G | H | I | J |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 16 | 14 | 14 | 14 |
| Anzahl Ausreißer (Laboratorien) | - | 2 | 1 | 1 |
| Anzahl berücksichtigter Ergebnisse | 32 | 28 | 28 | 28 |
| Mittelwert g/l | 0,778 0,530 * |
1,742 | 0,351 | 0,599 |
| Wiederholstandardabweichung (Sr) g/l | 0,020 | 0,012 | 0,013 | 0,014 |
| Relative Wiederholstandardabweichung (RSDr) (%) | 3,1 | 0,7 | 3,8 | 2,3 |
| Wiederholgrenze (r) g/l | 0,056 | 0,033 | 0,038 | 0,038 |
| Vergleichstandardabweichung (SR) g/l | 0,031 | 0,029 | 0,021 | 0,030 |
| Relative Vergleichstandardabweichung (RSDR) (%) | 4,8 | 1,6 | 5,9 | 5,0 |
| Vergleichgrenze (R) g/l | 0,088 | 0,080 | 0,058 | 0,084 |
Art der Proben:
G Ouzo, Splitwerte *
H Anis, Blindduplikate
I Likör mit Anis, Duplikate
J Likör mit Anis, Duplikate
VI. Glycyrrhizinsäure. Bestimmung von Glycyrrhizinsäure durch Hochleistungsflüssigchromatographie
1. Anwendungsbereich
Diese Methode eignet sich für die Bestimmung von Glycyrrhizinsäure in Spirituosen mit Anis durch Hochleistungsflüssigchromatographie (HPLC). Nach der Verordnung (EWG) Nr. 1576/89 müssen Spirituosen mit Anis, die die Bezeichnung "Pastis" tragen, einen Glycyrrhizinsäuregehalt von 0,05 g/l bis 0,5 g/l aufweisen.
2. Normen
ISO 3696: 1987 Wasser für analytische Laborzwecke - Spezifikation und Prüfverfahren.
3. Prinzip
Die Glycyrrhizinsäurekonzentration wird durch Hochleistungsflüssigchromatographie (HPLC) mit UV-Detektor bestimmt. Eine Standardlösung und die Probe werden filtriert und getrennt direkt in das HPLC-System eingespritzt.
4. Reagenzien und Material
Bei der Analyse sind ausschließlich Reagenzien von HPLC-Qualität, reines Ethanol und Wasser Grad 3 gemäß ISO 3696 zu verwenden.
4.1. Ethanol 96 % vol. (CAS 64-17-5)
4.2. Ammoniumglycyrrhizinat, C42H62O16.NH3 (Ammoniumsalz der Glycyrrhizinsäure)
(MG 839,98) (CAS 53956-04-0): Reinheit mindestens 90 %.
(MG Glycyrrhizinsäure 822,94)
4.3. Eisessig, CH3COOH (CAS 64-19-7)
4.4. Methanol, CH3OH (CAS 67-56-1)
4.5. Ethanol 50 % vol.
Herstellung von 1.000 ml bei 20 °C:
4.6. Zubereitung der HPLC-Elutionslösungen
4.6.1. Elutionslösung a (Beispiel):
80 Volumteile Wasser (2.0)
20 Volumteile Essigsäure ( 4.3).
Das Elutionsmittel wird fünf Minuten lang entgast.
Hinweis: Wenn das verwendete Wasser nicht mikrofiltriert wurde, sollte das zubereitete Elutionsmittel durch ein Filter für organische Lösungsmittel mit einer Porengröße von höchstens 0,45 µm filtriert werden.
4.6.2. Elutionslösung B
Methanol ( 4.4)
4.7. Zubereitung von Standardlösungen
Alle Standardlösungen müssen nach zwei Monaten frisch angesetzt werden.
4.7.1. Referenzlösung C
25 mg Ammoniumglycyrrhizinat ( 4.2) werden auf 0,1 mg genau in einen 100-ml-Messkolben eingewogen. Etwas Ethanol 50 % vol. ( 4.5) zugeben und das Ammoniumglycyrrhizinat auflösen. Wenn es gelöst ist, wird mit Ethanol 50 % vol. ( 4.5) zur Marke aufgefüllt.
Durch ein Filter für organische Lösungsmittel filtrieren.
4.7.2. Standardlösungen (zur Überprüfung der Linearität der Reaktion der Instrumente)
Zur Herstellung einer 1,0-g/l-Stammlösung werden 100 mg Ammoniumglycyrrhizinat ( 4.2) auf 0,1 mg genau in einen 100-ml-Messkolben eingewogen. Etwas Ethanol 50 % vol. ( 4.5) zugeben und das Ammoniumglycyrrhizinat auflösen. Wenn es gelöst ist, wird mit Ethanol 50 % vol. ( 4.5) zur Marke aufgefüllt.
Mindestens vier weitere Lösungen von 0,05, 0,1, 0,25 und 0,5 g/l Ammoniumglycyrrhizinat herstellen: 5, 10, 25 bzw. 50 ml der 1,0-g/l-Stammlösung in einzelne 100-ml-Messkolben pipettieren, mit Ethanol 45 % vol. ( 4.4) zur Marke auffüllen und gründlich mischen.
Alle Lösungen durch ein Filter für organische Lösungsmittel filtrieren.
5. Geräte und Ausrüstung
5.1. Trennsystem
5.1.1. Hochleistungsflüssigchromatograph
5.1.2. Pumpsystem zur Erzielung und Aufrechterhaltung einer konstanten oder programmierten Durchflussmenge mit hoher Genauigkeit
5.1.3. Detektorsystem durch Spektralphotometrie im UV-Bereich, einstellbar auf 254 nm
5.1.4. Lösungsmittelentgaser
5.2. Computergestützter Integrator oder Schreiber, dessen Leistungsfähigkeit mit den übrigen Geräten kompatibel ist
5.3. Säule (Beispiel):
Werkstoff: rostfreier Stahl oder Glas
Innendurchmesser: 4-5 mm
Länge: 100-250 mm
Stationäre Phase: octadecylmodifiziertes (C18) Kieselgel, vorzugsweise kugelförmig, mit einer max. Korngröße von 5 µm.
5.4. Laborgeräte
5.4.1. Analysenwaage, Genauigkeit 0,1 mg
5.4.2. Laborglasgeräte, Genauigkeitsklasse A
5.4.3. Mikromembran-Filtervorrichtung für kleine Volumina
6. Chromatographiebedingungen
6.1. Elutionsmerkmale: (Beispiel)
6.2. Detektor:
7. Verfahren
7.1. Vorbereitung der Spirituosenprobe
Erforderlichenfalls durch ein Filter für organische Lösungsmittel filtrieren (Porengröße: 0,45 µm).
7.2. Bestimmung
Nach Stabilisierung der Chromatographiebedingungen
c = C x (h x P x 823) / (H x 100 x 840)
Dabei ist:
c die Konzentration der in der untersuchten Spirituose enthaltenen Glycyrrhizinsäure in Gramm je Liter,
C die Konzentration des in der Referenzlösung enthaltenen Ammoniumglycyrrhizinats in Gramm je Liter,
H die Fläche (oder Höhe) des Glycyrrhizinsäurepeaks der Referenzlösung,
h die Fläche (oder Höhe) des Peaks der in der untersuchten Spirituose enthaltenen Glycyrrhizinsäure,
P die Reinheit der Referenzsubstanz Ammoniumglycyrrhizinat (in %),
823 die Molmasse von Glycyrrhizinsäure,
840 die Molmasse von Ammoniumglycyrrhizinat.
8. Leistungsmerkmale der Methode (Präzision)
Statistische Ergebnisse des Ringversuchs:
In der nachstehenden Tabelle sind die Werte für Glycyrrhizinsäure zusammengefasst.
Bei einem internationalen Ringversuch ergaben sich nach einem international abgestimmten Verfahren:
| Jahr des Ringversuchs | 1998 |
| Anzahl Laboratorien | 16 |
| Anzahl Proben | 5 |
| Analyt | Glycyrrhizinsäure |
| Proben | A | B | C | D | E |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 13 | 14 | 15 | 16 | 16 |
| Anzahl Ausreißer (Laboratorien) | 3 | 2 | 1 | - | - |
| Anzahl berücksichtigter Ergebnisse | 26 | 28 | 30 | 32 | 32 |
| Mittelwert g/l | 0,046 | 0,092 * 0,099 | 0,089 | 0,249 | 0,493 |
| Wiederholstandardabweichung (Sr) g/l | 0,001 | 0,001 | 0,001 | 0,002 | 0,003 |
| Relative Wiederholstandardabweichung (RSDr) (%) | 1,5 | 1,3 | 0,7 | 1,0 | 0,6 |
| Wiederholgrenze (r) g/l | 0,002 | 0,004 | 0,002 | 0,007 | 0,009 |
| Vergleichstandardabweichung (SR) g/l | 0,004 | 0,007 | 0,004 | 0,006 | 0,013 |
| Relative Vergleichstandardabweichung (RSDR) (%) | 8,6 | 7,2 | 4,0 | 2,5 | 2,7 |
| Vergleichgrenze (R) g/l | 0,011 | 0,019 | 0,010 | 0,018 | 0,037 |
Art der Proben:
a Pastis, Blindduplikate
B Pastis, Splitwerte *
C Pastis, Blindduplikate
D Pastis, Blindduplikate
E Pastis, Blindduplikate
VII. Chalkone. Hochleistungsflüssigchromatographie zum Nachweis von Chalkonen in Pastis
1. Geltungsbereich
Mit dieser Methode kann untersucht werden, ob Spirituosen mit Anis Chalkone enthalten oder nicht. Chalkone sind natürliche Farbstoffe aus der Familie der im Süßholz (Glycyrrhiza glabra) vorkommenden Flavonoide.
Spirituosen mit Anis dürfen nur dann als "Pastis" bezeichnet werden, wenn sie Chalkone enthalten. (Verordnung (EWG) Nr. 1576/89).
2. Normen
ISO 3696: 1987 Wasser für analytische Laborzwecke - Spezifikation und Prüfverfahren.
3. Prinzip
Eine Referenzsüßholzextraktlösung wird hergestellt. Durch Hochleistungsflüssigchromatographie (HPLC) mit UV-Detektor wird untersucht, ob Chalkone enthalten sind oder nicht.
4. Reagenzien und Material
Bei der Analyse sind ausschließlich Reagenzien von HPLC-Qualität, Ethanol 96 % vol. und Wasser Grad 3 gemäß ISO 3696 zu verwenden.
4.1. Ethanol 96 % vol. (CAS 64-17-5)
4.2. Acetonitril, CH3CN, (CAS 75-05-8)
4.3. Referenzsubstanz: Glycyrrhiza glabra: Lakritze, "Süßholz".
Grob zermahlenes Süßholz (Glycyrrhiza glabra). Durchschnittliche Größe der stäbchenförmigen Teilchen: Länge: 10-15 mm; Dicke: 1-3 mm
4.4. Natriumacetat, CH3COONa, (CAS 127-09-3)
4.5. Eisessig, CH3COOH, (CAS 64-19-7)
4.6. Zubereitung der Lösungen
4.6.1. Ethanol 50 % vol.
Zur Herstellung von 1.000 ml bei 20 °C:
4.6.2. Lösungsmittel A: Acetonitril
Acetonitril ( 4.2) HPLC-Qualität.
Entgasen.
4.6.3. Lösungsmittel B: 0,1 M Natriumacetatpufferlösung, pH-Wert 4,66
8,203 g Natriumacetat (4.4) werden in einen Messkolben eingewogen, es werden 6,005 g Eisessig ( 4.5) zugegeben und mit Wasser (2) auf 1.000 ml aufgefüllt.
5. Herstellung des Referenzextrakts von Glycyrrhiza glabra (4.3)
5.1. 10 g zerkleinertes Süßholz (Glycyrrhiza glabra) (4.3) werden abgewogen und in einen Destillierkolben gegeben.
5.2. Den Süßholzextrakt aus dem Filter nehmen.
5.3. Die Extraktion des Süßholzes ist dreimal hintereinander durchzuführen.
5.4. Die drei Filtrate werden zusammengeführt.
5.5. Die Lösungsmittelphase (von 5.4) auf einem Rotationsverdampfer verdampfen.
5.6. Den gewonnenen Extrakt (von 5.5) mit Hilfe von 100 ml Ethanol, 50 % vol., ( 4.6.1) aufnehmen.
6. Geräte und Ausrüstung
6.1. Trennsystem
6.1.1. Hochleistungsflüssigchromatograph
6.1.2. Pumpsystem zur Erzielung und Aufrechterhaltung einer konstanten oder programmierten Durchflussmenge bei hohem Druck
6.1.3. Detektorsystem durch Spektralphotometrie im UV-/sichtbaren Bereich, einstellbar auf 254 nm und 370 nm
6.1.4. Lösungsmittelentgaser
6.1.5. Säulenofen, auf eine Temperatur von 40 °C ± 0,1 °C einstellbar
6.2. Computergestützter Integrator oder Schreiber, dessen Leistungsfähigkeit mit den übrigen Geräten kompatibel ist.
6.3. Säule
Werkstoff: rostfreier Stahl oder Glas
Innendurchmesser: 4-5 mm
Stationäre Phase: octadecylmodifiziertes (C 18) Kieselgel mit einer max. Korngröße von 5 µm (modifizierte Phase).
6.4. Übliche Laborgeräte, insbesondere:
6.4.1. Analysenwaage (Genauigkeit: ± 0,1 mg)
6.4.2. Destillationsapparatur unter Rücklauf, beispielsweise bestehend aus:
6.4.3. Rotationsverdampfer
6.4.4. Filtriervorrichtung (z.B. Büchner-Trichter)
6.5. Chromatographiebedingungen (Beispiel)
6.5.1. Elutionsmerkmale der Lösungsmittel a ( 4.6.2) und B ( 4.6.3):
6.5.2. Förderrate: 1 ml/min.
6.5.3. UV-Detektoreinstellungen:
Für den Nachweis von Chalkonen ist der Detektor auf 370 nm einzustellen, dann für den Nachweis von Glycyrrhizinsäure auf 254 nm.
Hinweis: Die Änderung der Wellenlänge (von 370 nm zu 254 nm) muss 30 Sekunden vor Beginn des Elutionspeaks von Glycyrrhizinsäure vorgenommen werden.
7. Verfahren
7.1. Herstellen der Versuchsprobe
Erforderlichenfalls durch ein Filter für organische Lösungsmittel filtrieren (Porengröße: 0,45 µm).
7.2. Zubereitung des restlichen Süßholzextraktes ( 5.6)
Vor der Analyse ist eine 1:10-Verdünnung mit Ethanol 50 % ( 4.6.1) herzustellen.
7.3. Bestimmung
7.3.1. 20 µl des zubereiteten SÌßholzextrakts ( 7.2) einspritzen. Die Analyse ist gemäß den unter Nummer 6.5 beschriebenen Chromatographiebedingungen durchzuführen.
7.3.2. 20 µl der Probe ( 7.1) einspritzen (Spirituosenprobe mit Anis). Die Analyse ist gem´ß den unter Nummer 6.5 beschriebenen Chromatographiebedingungen durchzuführen.
7.3.3. Die beiden Chromatogramme werden verglichen. Die beiden Chromatogramme müssen im Ausgangsbereich der Chalkone sehr ähnlich sein (während des Nachweises bei 370 nm unter den beschriebenen Analysebedingungen). (s. Abbildung 1).
8. Charakteristisches Chromatogramm von Pastis
Durch die beschriebene Methode erhaltenes Chromatogramm, das zeigt, dass ein "Pastis" Chalkone enthält. Die Peaks 1-8 sind Chalkone, Peak 9 ist Glycyrrhizinsäure.
9. Leistungsmerkmale der Methode (Präzision)
Ergebnisse des Ringversuchs:
In der nachstehenden Tabelle sind die Ergebnisse der Untersuchung auf Chalkone in Pastis oder Spirituosen aufgeführt.
Bei einem internationalen Ringversuch ergaben sich nach einem international abgestimmten Verfahren folgende Daten:
| Jahr der gemeinsamen Tests | 1998 |
| Anzahl Laboratorien | 14 |
| Anzahl Proben | 11 |
| Analyten | Chalkone |
| Proben | A | B | C | D | E | F |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 14 | 14 | 14 | 14 | 14 | 13 |
| Anzahl Ausreißer (Laboratorien) | - | - | - | - | - | 1 * |
| Anzahl berücksichtigter Ergebnisse | 28 | 14 | 14 | 28 | 28 | 26 |
| Zahl der Ergebnisse: Chalkone enthalten | 28 | 14 | 14 | 0 | 28 | 0 |
| Zahl der Ergebnisse: keine Chalkone enthalten | 0 | 0 | 0 | 28 | 0 | 26 |
| Prozentsatz richtiger Ergebnisse (%) | 100 | 100 | 100 | 100 | 100 | 100 |
| *) widersprüchliche Ergebnisse bei zwei Duplikaten wegen Fehler bei der Probenahme | ||||||
| Proben | G | H | I | J | K |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 14 | 14 | 14 | 14 | 14 |
| Anzahl Ausreißer (Laboratorien) | - | - | - | - | - |
| Anzahl berücksichtigter Ergebnisse | 28 | 14 | 14 | 28 | 28 |
| Zahl der Ergebnisse: Chalkone enthalten | 0 | 0 | 0 | 0 | 0 |
| Zahl der Ergebnisse: keine Chalkone enthalten | 28 | 14 | 14 | 28 | 28 |
| Prozentsatz richtiger Ergebnisse (%) | 100 | 100 | 100 | 100 | 100 |
Art der Proben:
a Pastis, Blindduplikate
B Pastis, Einzelprobe
C Pastis, Einzelprobe
D "Pastis" (ohne Chalkone), Blindduplikate
E "Pastis" (ohne Chalkone), Blindduplikate
F Likör mit Anis (ohne Chalkone), Blindduplikate
G Likör mit Anis (ohne Chalkone), Blindduplikate
H Ouzo (ohne Chalkone), Einzelprobe
I Ouzo (ohne Chalkone), Einzelprobe
J Anis (ohne Chalkone), Blindduplikate
K "Pastis" (ohne Chalkone), Blindduplikate
VIII. Gesamtzucker16
1. Anwendungsbereich
Die HPLC-RI-Methode eignet sich für die Bestimmung der Gesamtzucker (ausgedrückt als Invertzucker) in Spirituosen, mit Ausnahme von Likören, die Ei und Milcherzeugnisse enthalten.
Die Methode wurde in einem Ringversuch für Pastis, Ouzo, Kirschlikör, Crème de (gefolgt vom Namen einer Frucht oder des verwendeten Rohstoffs) und Crème de cassis bei Konzentrationen von 10,86 g/l bis 509,7 g/l validiert. Die Linearität der Empfindlichkeit des Messgeräts war jedoch für den Konzentrationsbereich von 2,5 g/l bis 20,0 g/l nachgewiesen.
Diese Methode eignet sich nicht zur Bestimmung geringer Zuckerkonzentrationen.
2. Normen
ISO 3696:1987 Wasser für Analysezwecke - Spezifikationen und Testverfahren
3. Prinzip
Hochleistungsflüssigkeitschromatografische Untersuchungen von Zuckerlösungen zur Bestimmung ihrer Konzentrationen an Glucose, Fructose, Saccharose, Maltose und Lactose.
Bei dieser Methode wird als stationäre Phase ein Alkylamin und für die Detektion ein Brechungsindexdetektor (RI) verwendet. Es handelt sich um ein Beispiel. Als stationäre Phase könnten auch Anionenaustauscherharze verwendet werden.
4. Reagenzien und Material
4.1. Glucose (CAS 50-99-7), Reinheit mindestens 99 %.
4.2. Fructose (CAS 57-48-7), Reinheit mindestens 99 %.
4.3. Saccharose (CAS 57-50-1), Reinheit mindestens 99 %.
4.4. Lactose (CAS 5965-66-2), Reinheit mindestens 99 %.
4.5. Maltose-Monohydrat (CAS 6363-53-7), Reinheit mindestens 99 %.
4.6. Reines Acetonitril (CAS 75-05-8) für HPLC-Analyse.
4.7. Destilliertes oder entmineralisiertes Wasser, vorzugsweise mikrofiltriert.
4.8. Lösungsmittel (Beispiel)
Das Elutionsmittel besteht aus
75 Volumenteilen Acetonitril ( 4.6),
25 Volumenteilen destilliertem Wasser ( 4.7).
Vor Verwendung 5 bis 10 Min. im schwachen Heliumstrom entgasen.
Wenn das verwendete Wasser nicht mikrofiltriert wurde, sollte das Lösungsmittel mit einem Filter für organische Lösungsmittel mit einer Maschenweite von höchstens 0,45 µm filtriert werden.
4.9. Reines Ethanol (CAS 64-17-5)
4.10. Ethanollösung (Volumenkonzentration = 5 %)
4.11. Ansetzen der Standard-Stammlösung (20 g/l) Von jedem der zu analysierenden Zucker ( 4.1 bis 4.5) 2 g abwiegen und verlustfrei in einen 100-ml-Messkolben überführen. (Hinweis: 2,11 g Maltose-Monohydrat entsprechen 2 g Maltose.)
Mit der Ethanollösung 5 Vol.- % ( 4.10) auf 100 ml auffüllen, schütteln und bei etwa + 4 °C lagern. Die Standard-Stammlösung einmal wöchentlich neu anzusetzen.
4.12. Ansetzen von Standard-Arbeitslösungen (2,5, 5,0, 7,5, 10,0 und 20,0 g/l) Die Stammlösung, 20 g/l, ( 4.11) mit der 5 Vol.- % Ethanollösung ( 4.10) zu fünf Standardarbeitslösungen verdünnen: 2,5, 5,0, 7,5, 10,0 und 20,0 g/l. Durch ein Filter mit einer Maschenweite von höchstens 0,45 µm ( 5.3.) filtrieren.
5. Gerät und Ausrüstung
5.1. HPLC-System, das eine Basislinien-Auflösung aller Zucker erreichen kann
5.1.1. Hochleistungsflüssigkeitschromatograf mit einem 6-Wege-Injektionsventil mit 10-µl-Dosierungsschleife oder einer anderen Dosierungsvorrichtung, automatisch oder manuell, für die zuverlässige Injektion von Mikrovolumina
5.1.2. Pumpsystem zur Erzielung und Aufrechterhaltung einer konstanten oder programmierten Durchflussmenge mit hoher Genauigkeit
5.1.3. Differentialrefraktometer
5.1.4. Computergestützter Integrator oder Schreiber, dessen Leistungsfähigkeit mit den übrigen Geräten kompatibel ist
5.1.5. Vorsäule
Es wird empfohlen, die Analysesäule mit einer geeigneten Vorsäule zu verbinden.
5.1.6. Säule (Beispiel)
| Material: | rostfreier Stahl oder Glas |
| Innendurchmesser: | 2-5 mm |
| Länge: | 100-250 mm (je nach Partikelgröße der Packung), z.B. 250 mm bei einer Partikelgröße von 5 µm |
| Stationäre Phase: | an Kieselgel gebundene funktionelle Alkylamingruppen, Partikelgröße höchstens 5 µm. |
5.1.7. Chromatografiebedingungen (Beispiel)
Elutionsmittel ( 4.8.), Strömungsgeschwindigkeit: 1 ml/min
Detektion: Differentialrefraktometrie
Um sicherzustellen, dass der Detektor vollkommen stabil ist, sollte er einige Stunden vor Verwendung eingeschaltet werden. Die Referenzzelle muss mit dem Elutionsmittel gefüllt sein.
5.2. Analysenwaage, Genauigkeit 0,1 mg
5.3. Mikromembran-Filtervorrichtung (0,45 µm) für kleine Volumina
6. Lagerung der Proben
Die Proben sollten nach Erhalt bis zur Analyse bei Raumtemperatur aufbewahrt werden.
7. Verfahren
7.1. TEIL A: Vorbereitung der Probe
7.1.1. Die Probe schütteln.
7.1.2. Die Probe durch ein Filter mit einer Maschenweite von höchstens 0,45 µm ( 5.3) filtrieren.
7.2. TEIL B: HPLC
7.2.1. Bestimmung
10 µl der Standardlösungen ( 4.12) und der Proben ( 7.1.2) injizieren. Die Analyse unter geeigneten Chromatografiebedingungen, z.B. wie oben beschrieben, durchführen.
7.2.2. Sollte ein Peak einer Probe eine größere Fläche (oder Höhe) aufweisen als der entsprechende Peak der Standardlösung mit der höchsten Konzentration, ist die Probe mit destilliertem Wasser zu verdünnen und erneut zu analysieren.
8. Berechnung
Die Chromatogramme der Standardlösung und der Spirituose sind zu vergleichen. Die Peaks sind nach ihren Retentionszeiten zu identifizieren. Ihre Flächen (oder Höhen) messen und die Konzentrationen nach der Methode des externen Standards berechnen. Dabei sind etwaige Verdünnungen der Probe zu berücksichtigen.
Das Endergebnis ist die Summe von Saccharose, Maltose, Lactose, Glucose und Fructose, ausgedrückt als Invertzucker in g/l.
Invertzucker wird berechnet als Summe der vorhandenen Monosaccharide und reduzierenden Disaccharide zuzüglich der aus der vorhandenen Saccharose errechneten stöchiometrischen Menge Glucose und Fructose.
| Invertzucker (g/l) | = Glucose (g/l) + Fructose (g/l) + Maltose (g/l) + Lactose (g/l) + (Saccharose (g/l) x 1,05) |
| 1,05 | = (Molekulargewicht von Fructose + Molekulargewicht von Glucose)/Molekulargewicht von Saccharose |
9. Leistungsmerkmale der Methode (Präzision)
9.1. Statistische Ergebnisse des Ringversuchs
Bei einem internationalen Ringversuch ergaben sich nach einem international abgestimmten Verfahren [1] [2] folgende Daten:
| Jahr des Ringversuchs | 2000 |
| Anzahl der Laboratorien | 24 |
| Anzahl der Proben | 8 |
[1] , Protocol for the Design, Conduct and Interpretation of Method- Performance Studies', Horwitz, W. (1995) Pure and Applied Chemistry 67, 332-343.
[2] Horwitz, W. (1982) Analytical Chemistry 54, 67A-76A.
Tabelle 1: Fructose, Glucose, Maltose
| Analyt | Fructose | Glucose | Maltose | ||||
| Proben (x 2) | Crème de Cassis | Standard (50 g/l) |
Spirituose mit Anis | Crème de Cassis | Standard (50 g/l) |
Spirituose mit Anis | Standard (10 g/l) |
| Mittelwert [g/l] | 92,78 | 50,61 | 15,62 | 93,16 | 50,06 | 15,81 | 9,32 |
| Anzahl der Laboratorien ohne Ausreißer | 21 | 22 | 21 | 23 | 19 | 21 | 22 |
| Wiederholstandardabweichung sr, [g/l] | 2,34 | 2,12 | 0,43 | 3,47 | 1,01 | 0,48 | 0,54 |
| Relative Wiederholstandardabweichung, RSDr [%] | 2,53 | 4,2 | 2,76 | 3,72 | 2,03 | 3,02 | 5,77 |
| Wiederholgrenze r [g/l] (r = 2,8 x sr) | 6,56 | 5,95 | 1,21 | 9,71 | 2,84 | 1,34 | 1,51 |
| Vergleichstandardabweichung sR [g/l] | 7,72 | 3,13 | 0,84 | 9,99 | 2,7 | 0,88 | 1,4 |
| Relative Vergleichstandardabweichung, RSDR [%] | 8,32 | 6,18 | 5,37 | 10,72 | 5,4 | 5,54 | 15,06 |
| Vergleichgrenze, R [g/l] (R = 2,8 x sR) |
21,62 | 8,76 | 2,35 | 27,97 | 7,57 | 2,45 | 3,93 |
Tabelle 2: Saccharose
| Analyt | Saccharose | |||||
| Proben | Pastis | Ouzo | Kirschlikör | Crème de Menthe | Crème de Cassis | Standard (100 g/l) |
| Mittelwert [g/l] | 10,83 | 29,2 19,7 * |
103,33 | 349,96 | 319,84 | 99,83 |
| Anzahl der Laboratorien ohne Ausreißer | 19 | 19 | 20 | 18 | 18 | 18 |
| Wiederholstandardabweichung sr [g/l] | 0,09 | 0,75 | 2,17 | 5,99 | 4,31 | 1,25 |
| Relative Wiederholstandardabweichung, RSDr [%] | 0,81 | 3,07 | 2,1 | 1,71 | 1,35 | 1,25 |
| Wiederholgrenze r [g/l] (r = 2,8 x sr) |
0,25 | 2,1 | 6,07 | 16,76 | 12,06 | 3,49 |
| Vergleichstandardabweichung sR [g/l] | 0,79 | 0,92 | 4,18 | 9,94 | 16,11 | 4,63 |
| Relative Vergleichstandard- abweichung, RSDR [%] | 7,31 | 3,76 | 4,05 | 2,84 | 5,04 | 4,64 |
| Vergleichgrenze, R [g/l] (R = 2,8 x sR) |
2,22 | 2,57 | 11,7 | 27,84 | 45,12 | 12,97 |
| *) Splitwert | ||||||
Tabelle 3: Gesamtzucker
(Hinweis: Diese Daten wurden für Gesamtzucker berechnet, nicht für Invertzucker gemäß der Definition unter Nummer 8.)
| Proben | Pastis | Ouzo | Spirituose mit Anis | Kirschlikör | Crème de Menthe | Crème de Cassis | Standard (220 g/l) |
| Mittelwert [g/l] | 10,86 | 29,2 19,7 * |
31,59 | 103,33 | 349,73 | 509,69 | 218,78 |
| Anzahl der Laboratorien ohne Ausreißer | 20 | 19 | 20 | 20 | 18 | 18 | 19 |
| Wiederholstandardabweichung sr [g/l] | 0,13 | 0,75 | 0,77 | 2,17 | 5,89 | 5,59 | 2,71 |
| Relative Wiederholstandardabweichung, RSDr [%] | 1,16 | 3,07 | 2,45 | 2,1 | 1,69 | 1,1 | 1,24 |
| Wiederholgrenze r [g/l] (r = 2,8 x sr) |
0,35 | 2,1 | 2,17 | 6,07 | 16,5 | 15,65 | 7,59 |
| Vergleichstandardabweichung sR [g/l] | 0,79 | 0,92 | 1,51 | 4,18 | 9,98 | 14,81 | 8,53 |
| Relative Vergleichstandardabweichung, RSDR [%] | 7,25 | 3,76 | 4,79 | 4,04 | 2,85 | 2,91 | 3,9 |
| Vergleichgrenze R [g/l] (R = 2,8 x sR] |
2,21 | 2,57 | 4,24 | 11,7 | 27,94 | 41,48 | 23,89 |
| *) Splitwert | |||||||
IX. Eigelb. Bestimmung der Eigelbkonzentration in Spirituosen - Photometrische Methode
1. Geltungsbereich
Die Methode ist geeignet für die Bestimmung von Eigelbkonzentrationen zwischen 40 und 250 g/l in Eierlikör und Likör mit Eizusatz.
2. Normen
ISO 3696: 1897 Wasser für analytische Laborzwecke - Spezifikation und Prüfverfahren.
3. Prinzip
Die ethanollöslichen Phosphorverbindungen im Eigelb werden extrahiert und als Phosphormolybdatkomplex photometrisch bestimmt.
4. Reagenzien und Material
4.1. Bidestilliertes Wasser
4.2. Kieselgur
4.3. Ethanol 96 % vol. (CAS 64-17-5)
4.4. 15%ige Lösung von Magnesiumacetat (CAS 16674-78-5)
4.5. 10%ige Schwefelsäure (CAS 7664-93-9)
4.6. 1-N-Schwefelsäure.
4.7. Lösung von Kaliumdihydrogenphosphat (CAS 778-77-0), KH2PO4, 0,16 g/l.
4.8. Reagenz für die Phosphatbestimmung:
20 g Ammoniummolybdat (CAS 12054-85-2), (NH4)6Mo7O24.4H2O werden in 400 ml Wasser bei 50 °C gelöst.
In einem anderen Gefäß löst man 1 g Ammoniumvanadat (CAS 7803-55-6), NH4VO3, in 300 ml heißem Wasser und fügt nach Abkühlung 140 ml konzentrierte Salpetersäure (CAS 7697-37-2) hinzu. Die kalten Lösungen werden in einem 1.000 -ml-Messkolben vereinigt und bis zur Marke aufgefüllt.
5. Geräte und Ausrüstung
5.1. 100-ml-Erlenmeyerkolben
5.2. Ultraschallbad (oder Magnetrührer)
5.3. 100-ml-Messkolben
5.4. Wasserbad 20 °C
5.5. Filter (Whatman Nr. 4 oder gleichwertig)
5.6. Tiegel aus Porzellan (oder Platin)
5.7. Kochendes Wasserbad
5.8. Heizplatte
5.9. Muffelofen
5.10. 50-ml-Messkolben
5.11. 20-ml-Messkolben
5.12. Spektralphotometer, 420 nm.
5.13. Küvette, 1 cm.
6. Proben
Die Proben werden vor der Analyse bei Zimmertemperatur gelagert.
7. Verfahren
7.1. Vorbereitung der Probe
7.1.1. 10 g der Probe werden in einen 100-ml-Erlenmeyerkolben ( 5.1) eingewogen.
7.1.2. In kleinen Anteilen unter Rühren nach und nach 70 ml Ethanol ( 4.3) zusetzen, 15 Minuten in ein Ultraschallbad ( 5.2) geben (oder die Mischung bei Zimmertemperatur 10 Minuten mit einem Magnetrührer ( 5.2) rühren.
7.1.3. Den Inhalt des Kolbens mit Ethanol-Spülung ( 4.3) in einen 100-ml-Messkolben ( 5.3) überführen. Bis zur Eichmarke mit Ethanol ( 4.3) auffüllen und die Kolben in ein Wasserbad von 20 °C ( 5.4) setzen. Bei 20 °C auf die Eichmarke einstellen.
7.1.4. Etwas Kieselgur ( 4.2) zugeben und filtrieren ( 5.5); die ersten 20 ml sind zu verwerfen.
7.1.5. 25 ml des Filtrats werden in einen Tiegel aus Porzellan (oder Platin) ( 5.6) überführt. Das Filtrat muss dann durch vorsichtiges Verdampfen im kochenden Wasserbad ( 5.7) unter Zusatz von 5 ml 15%iger Magnesiumacetatlösung ( 4.4) konzentriert werden.
7.1.6. Die Tiegel werden auf einer Heizplatte ( 5.8) erhitzt, bis sie gerade trocken sind.
7.1.7. Der Rückstand wird verascht und bei 600 °C in einem Muffelofen ( 5.9) geglüht, bis die Asche weiß ist (mindestens 1,5 Stunden oder auch über Nacht).
7.1.8. Die Asche wird mit 10 ml 10%iger Schwefelsäure ( 4.5) aufgenommen und mit Spülung von destilliertem Wasser ( 4.1) in einen 50-ml-Messkolben ( 5.10) überführt, der bei Zimmertemperatur bis zur Marke mit destilliertem Wasser aufgefüllt wird ( 4.1). Ein aliquoter Teil (5 ml) dieser Lösung wird verwendet, um die Probenlösung für die photometrische Phosphatbestimmung zuzubereiten.
7.2. Photometrische Phosphatbestimmung
7.2.1. Vergleichslösung
7.2.1.1. 10 ml der 10%igen Schwefelsäure ( 4.5) werden in einen 50-ml-Messkolben ( 5.10) gegeben und bis zur Marke mit destilliertem Wasser ( 4.1) aufgefüllt.
7.2.1.2 Zu einem aliquoten Teil von 5 ml dieser Lösung ( 7.2.1.1) in einem 20-ml-Messkolben ( 5.11) werden 1 ml 1-N-Schwefelsäure ( 4.6) und 2 ml Phosphatreagenz ( 4.8) zugesetzt; mit destillierten Wasser ( 4.1) wird auf 20 ml aufgefüllt.
7.2.1.3. Mit einem locker eingesetzten Stopfen verschließen, schütteln und in einem kochenden Wasserbad ( 5.7) 10 Minuten erhitzen, dann in einem Wasserbad von 20 °C ( 5.4) 20 Minuten abkühlen.
7.2.1.4 Eine 1-cm-Küvette ( 5.13) mit dieser Vergleichslösung füllen.
7.2.2. Probenlösung
7.2.2.1. Zu einem aliquoten Teil von 5 ml der Aschelösung ( 7.1.8) in einem 20-ml-Messkolben ( 5.11) werden 1 ml 1-N-Schwefelsäure ( 4.6) und 2 ml Phosphatreagenz ( 4.8) zugesetzt; mit destillierten Wasser (4.1) wird auf 20 ml aufgefüllt.
7.2.2.2 Mit einem locker eingesetzten Stopfen verschließen, schütteln und in einem kochenden Wasserbad ( 5.7) 10 Minuten erhitzen, dann in einem Wasserbad von 20 °C ( 5.4) 20 Minuten abkühlen.
7.2.2.3. Die entstehende gelbe Lösung wird unverzüglich spektroskopisch ( 5.12) in einer 1-cm-Küvette ( 5.13) bei 420 nm gegenüber der Vergleichslösung ( 7.2.1.4) analysiert.
7.2.3. Eichkurve
7.2.3.1. Zur Erstellung der Eichkurve werden aliquote Mengen (2 ml) des Phosphatreagenz ( 4.8) in 20-ml-Messkolben ( 5.11) gegeben, die jeweils 1 ml 1-N-Schwefelsäure ( 4.6) und 0, 2, 4, 6, 8 bzw. 10 ml Kaliumdihydrogenphosphatlösung ( 4.7) enthalten, und mit destilliertem Wasser ( 4.1) bis zur Marke aufgefüllt.
7.2.3.2 Mit einem locker eingesetzten Stopfen verschließen, schütteln und in einem kochenden Wasserbad ( 5.7) 10 Minuten erhitzen, dann in einem Wasserbad von 20 °C ( 5.4) 20 Minuten abkühlen und in einer 1-cm-Küvette ( 5.13) bei 420 nm spektroskopisch ( 5.12) gegenüber der Vergleichslösung ( 7.2.1.4) analysieren.
7.2.3.3. Erstellung der Eichkurve:
| Kaliumdihydrogenphosphatlösung (ml) | 0 | 2 | 4 | 6 | 8 | 10 |
| P2O5 (mg) | 0 | 0,167 | 0,334 | 0,501 | 0,668 | 0,835 |
8. Berechnung der Ergebnisse
Der Eigelbgehalt in g/l wird nach folgender Formel berechnet:
g/L Eigelb = mg P2O5 x [(100 x Dichte) / (E/40)]
Dabei ist:
110 Umrechnungsfaktor für Gesamtgehalt an P2O5 in g in 100 g Eigelb,
mg P2O5 anhand der Eichkurve festgestellter Wert,
Dichte Masse je Volumeneinheit (g/ml) des Eierlikörs bei 20 °C,
E Gewicht des Eierlikörs in g,
40 Verdünnungsfaktor für einen aliquoten Teil von 5 ml der Aschelösung.
9. Leistungsmerkmale der Methode (Präzision)
Statistische Ergebnisse des Ringversuchs:
In der nachstehenden Tabelle sind die Werte für Eigelb zusammengefasst.
Bei einem internationalen Ringversuch ergaben sich nach einem international abgestimmten Verfahren folgende Daten:
| Jahr des Ringversuchs: | 1998 |
| Anzahl Laboratorien: | 24 |
| Anzahl Proben: | 5 |
| Analyt: | Eigelb |
| Proben | A | B | C | D | E |
| Anzahl der nach Beseitigung der Ausreißer berücksichtigten Laboratorien | 19 | 20 | 22 | 20 | 22 |
| Anzahl Ausreißer (Laboratorien) | 3 | 4 | 2 | 4 | 2 |
| Anzahl berücksichtigter Ergebnisse | 38 | 40 | 44 | 40 | 44 |
| Mittelwert | 147,3 | 241,1 | 227,4 | 51,9 * 72,8 * |
191,1 |
| Wiederholstandardabweichung (Sr) g/l | 2,44 | 4,24 | 3,93 | 1,83 | 3,25 |
| Relative Wiederholstandardabweichung (RSDr) (%) | 1,7 | 1,8 | 1,8 | 2,9 | 1,7 |
| Wiederholgrenze (r) g/l | 6,8 | 11,9 | 11,0 | 5,1 | 9,1 |
| Vergleichstandardabweichung (SR) g/l | 5,01 | 6,06 | 6,66 | 3,42 | 6,87 |
| Relative Vergleichstandardabweichung (RSDR) (%) | 3,4 | 2,5 | 2,9 | 5,5 | 3,6 |
| Vergleichgrenze (R) g/L | 14,0 | 17,0 | 18,7 | 9,6 | 19,2 |
Art der Proben:
a Advocaat, Blindduplikate
B Advocaat, Blindduplikate
C Advocaat, Blindduplikate
D Advocaat (verdünnt), Splitwerte *
E Advocaat, Blindduplikate
X. Bestimmung der folgenden aus Holz austretenden Verbindungen in Spirituosen durch Hochleistungsflüssigkeitschromatografie (HPLC): Furfural, Hydroxymethyl-5-furfural, Methyl-5-furfural, Vanillin, Syringaldehyd, Coniferaldehyd, Sinapaldehyd, Gallussäure, Ellagsäure, Vanillinsäure, Syringasäure und Scopoletin16
1. Anwendungsbereich
Die Methode dient der Bestimmung von Furfural, Hydroxymethyl-5-furfural, Methyl-5-furfural, Vanillin, Syringaldehyd, Coniferaldehyd, Sinapaldehyd, Gallussäure, Ellagsäure, Vanillinsäure, Syringasäure und Scopoletin durch Hochleistungsflüssigkeitschromatografie.
2. Normen
Von der Generalversammlung der Internationalen Organisation für Rebe und Wein (OIV) anerkannte und unter OIV-MA-BS-16: R2009 veröffentlichte Analysemethode.
3. Prinzip
Bestimmung durch Hochleistungsflüssigkeitschromatografie (HPLC) mit Detektion durch UV-Spektrophotometrie in mehreren Wellenlängen und durch Spektrofluorimetrie.
4. Reagenzien
Die Reagenzien müssen Analysequalität haben. Das verwendete Wasser muss destilliertes Wasser oder von mindestens gleichwertiger Reinheit sein. Es wird empfohlen, mikrofiltriertes Wasser mit einer Resistivität von 18,2 M Ω.cm zu verwenden.
4.1. Alkohol 96 Vol.- %
4.2. Methanol in HPLC-Qualität (Lösungsmittel B)
4.3. Essigsäure 0,5 % (Lösungsmittel A)
4.4. Mobile Phasen: (nur als Beispiel) Lösungsmittel a (0,5 %ige Essigsäure) und Lösungsmittel B (reines Methanol) über eine Membran filtern (Maschenweite 0,45 µm). Falls erforderlich in Ultraschallwanne entgasen.
4.5. Standardmaterial, mindestens 99 % rein: Furfural, Hydroxymethyl-5-furfural, Methyl-5-furfural, Vanillin, Syringaldehyd, Coniferaldehyd, Sinapaldehyd, Gallussäure, Ellagsäure, Vanillinsäure, Syringasäure und Scopoletin
4.6. Standardlösung: Das Standardmaterial wird in einer wässrigen Alkohollösung zu 50 Vol.- % gelöst. Die Konzentration in der Standardlösung beträgt:
Furfural: 5 mg/l; Hydroxymethyl-5-furfural: 10 mg/l; Methyl-5-furfural: 2 mg/l; Vanillin: 5 mg/l; Syringaldehyd: 10 mg/l; Coniferaldehyd: 5 mg/l; Sinapaldehyd: 5 mg/l; Gallussäure: 10 mg/l; Ellagsäure: 10 mg/l; Vanillinsäure: 5 mg/l; Syringasäure: 5 mg/l; Scopoletin: 0,5 mg/l.
5. Geräte
Übliche Laborgeräte sowie
5.1. Hochleistungsflüssigkeitschromatograf, der mit Binärgradient betrieben werden kann und folgende Ausstattung aufweist:
5.1.1. Ein spektrophotometrischer Detektor, mit dem Messungen bei Wellenlängen von 260 bis 340 nm vorgenommen werden können. Vorzugsweise wird mit einem Detektor für mehrere Wellenlängen gearbeitet, zum Beispiel mit einem Diodenarray, um die Reinheit der Peaks bestätigen zu können.
5.1.2. Ein spektrofluorimetrischer Detektor, Wellenlänge für die Anregung: 354 nm, Wellenlänge für die Emission: 446 nm (zur Feinbestimmung von Scopoletin; es ist aber auch bei 313 nm durch Spektrophotometrie bestimmbar.)
5.1.3. Eine Injektionsvorrichtung zum Injizieren von Proben zu 10 oder 20 µl
5.1.4. Eine HPLC-Säule vom Typ RP C18, Granulometrie höchstens 5 µm
5.2. Spritzen für HPLC
5.3. Membranfilter für kleine Mengen
5.4. Rechner oder Schreiber, dessen Leistung mit den Geräten kompatibel ist. Er muss vor allen Dingen mehrere Erfassungskanäle aufweisen.
6. Verfahren
6.1. Vorbereitung der einzuspritzenden Lösung
Die Standardlösung und die Spirituose werden, falls erforderlich, über eine Membran gefiltert, deren Maschenweite höchstens 0,45 µm beträgt.
6.2. Parameter für die Chromatografie
Die Analyse bei Raumtemperatur mit der unter 5.1 genannten Ausrüstung durchführen, dabei die mobilen Phasen ( 4.4) mit einem Durchsatz von etwa 0,6 ml pro Minute nach folgendem Programm verwenden (nur als Beispiel):
Zeit: 0 min 50 min 70 min 90 min
Lösungsmittel a (Wasser-Säure): 100 % 60 % 100 % 100 %
Lösungsmittel B: (Methanol): 0 % 40 % 0 % 0 %
Zur Vermeidung von Co-Elutionen ist dieser Gradient in einigen Fällen jedoch zu ändern.
6.3. Bestimmung
6.3.1. Das Standardmaterial getrennt, dann gemischt injizieren.
Die Betriebsparameter so anpassen, dass der Auflösungsfaktor der Peaks bei allen Verbindungen mindestens gleich 1 ist.
6.3.2. Die wie in 6.1 vorbereitete Probe injizieren.
6.3.3. Die Fläche der Peaks der Standardlösung und der Spirituose messen und die Konzentration berechnen.
7. Darstellung der Ergebnisse
Die Konzentration jedes Bestandteils wird in mg/l ausgedrückt.
8. Leistungsmerkmale der Methode (Präzision)
Die folgenden Angaben stammen aus einer internationalen Studie aus dem Jahr 2009 zur Leistungsfähigkeit der Methode, wobei die Studie gemäß den international anerkannten Verfahren für unterschiedliche Spirituosen durchgeführt wurde [1], [2].
8.1. Furfural
| Analyt | Furfural | |||||
| Proben | Whisky | Brandy | Rum | Cognac 1 | Bourbon | Cognac 2 |
| Anzahl der teilnehmenden Laboratorien | 15 | 15 | 15 | 15 | 15 | 15 |
| Anzahl berücksichtigter Ergebnisse (Laboratorien) | 14 | 12 | 13 | 14 | 13 | 13 |
| Mittelwert [mg/l] | 2,9 | 1,2 | 1,7 | 10,6 | 15,3 | 13,9 |
| Wiederholstandardabweichung sR [mg/l] | 0,04 | 0,05 | 0,04 | 0,18 | 0,23 | 0,20 |
| Relative Wiederholstandard- abweichung, RSDr [%] | 1,4 | 4,5 | 2,3 | 1,7 | 1,5 | 1,5 |
| Wiederholgrenze r [mg/l] (r = 2,8 x sr) |
0,1 | 0,2 | 0,1 | 0,5 | 0,6 | 0,6 |
| Vergleichstandardabweichung sR [mg/l] | 0,24 | 0,18 | 0,09 | 1,4 | 0,49 | 0,69 |
| Relative Vergleichstandardabweichung, RSDR [%] | 8 | 15 | 5 | 13 | 3 | 5 |
| Vergleichgrenze, R [g/l] (R = 2,8 x sR] |
0,7 | 0,5 | 0,3 | 3,8 | 1,4 | 1,9 |
8.2. Hydroxymethyl-5-furfural
| Analyt | Hydroxymethyl- 5 -furfural | |||||
| Proben | Whisky | Brandy | Rum | Cognac 1 | Bourbon | Cognac 2 |
| Anzahl der teilnehmenden Laboratorien | 16 | 16 | 16 | 16 | 16 | 16 |
| Anzahl berücksichtigter Ergebnisse (Laboratorien) | 14 | 14 | 14 | 14 | 14 | 14 |
| Mittelwert [mg/l] | 5,0 | 11,1 | 9,4 | 33,7 | 5,8 | 17,5 |
| Wiederholstandardabweichung sR [mg/l] | 0,09 | 0,09 | 0,09 | 0,42 | 0,07 | 0,13 |
| Relative Wiederholstandardabweichung, RSDr [%] | 1,7 | 0,8 | 1,0 | 1,3 | 1,2 | 0,8 |
| Wiederholgrenze r [mg/l] (r = 2,8 x sr) |
0,2 | 0,3 | 0,3 | 1,2 | 0,2 | 0,4 |
| Vergleichstandardabweichung sR [mg/l] | 0,39 | 1,01 | 0,50 | 4,5 | 0,4 | 1,6 |
| Relative Vergleichstandardabweichung, RSDR [%] | 8 | 9 | 5 | 13 | 7 | 9 |
| Vergleichgrenze, R [g/l] (R = 2,8 x sR] |
1,1 | 2,8 | 1,4 | 12,5 | 1,1 | 4,6 |
8.3. Methyl-5-furfural
| Analyt | Methyl-5-furfural | |||||
| Proben | Whisky | Brandy | Rum | Cognac 1 | Bourbon | Cognac 2 |
| Anzahl der teilnehmenden Laboratorien | 11 | 11 | 11 | 11 | 11 | 11 |
| Anzahl berücksichtigter Ergebnisse (Laboratorien) | 11 | 11 | 8 | 11 | 10 | 11 |
| Mittelwert [mg/l] | 0,1 | 0,2 | 0,1 | 0,5 | 1,7 | 0,8 |
| Wiederholstandardabweichung sR [mg/l] | 0,01 | 0,01 | 0,02 | 0,02 | 0,03 | 0,07 |
| Relative Wiederholstandardabweichung, RSDr [%] | 10,7 | 6,1 | 13,6 | 4,7 | 2,0 | 10,0 |
| Wiederholgrenze r [mg/l] (r = 2,8 x sr) |
0,1 | 0,1 | 0,1 | 0,2 | ||
| Vergleichstandardabweichung sR [mg/l] | 0,03 | 0,04 | 0,03 | 0,18 | 0,20 | 0,26 |
| Relative Vergleichstandardabweichung, RSDR [%] | 35 | 18 | 22 | 39 | 12 | 35 |
| Vergleichgrenze, R [g/l] (R = 2,8 x sR] |
0,1 | 0,1 | 0,1 | 0,5 | 0,6 | 0,7 |
8.4. Vanillin
| Analyt | Vanillin | |||||
| Proben | Whisky | Brandy | Rum | Cognac 1 | Bourbon | Cognac 2 |
| Anzahl der teilnehmenden Laboratorien | 16 | 15 | 16 | 16 | 16 | 16 |
| Anzahl berücksichtigter Ergebnisse (Laboratorien) | 16 | 15 | 16 | 16 | 16 | 16 |
| Mittelwert [mg/l] | 0,5 | 0,2 | 1,2 | 1,2 | 3,2 | 3,9 |
| Wiederholstandardabweichung sR [mg/l] | 0,03 | 0,02 | 0,06 | 0,11 | 0,11 | 0,09 |
| Relative Wiederholstandardabweichung, RSDr [%] | 6,8 | 9,6 | 4,6 | 8,9 | 3,5 | 2,3 |
| Wiederholgrenze r [mg/l] (r = 2,8 x sr) |
0,1 | 0,1 | 0,2 | 0,3 | 0,3 | 0,3 |
| Vergleichstandardabweichung sR [mg/l] | 0,09 | 0,06 | 0,18 | 0,27 | 0,41 | 0,62 |
| Relative Vergleichstandardabweichung, RSDR [%] | 19 | 25 | 15 | 22 | 13 | 16 |
| Vergleichgrenze, R [g/l] (R = 2,8 x sR] |
0,3 | 0,2 | 0,5 | 0,8 | 1,2 | 1,7 |
8.5. Syringaldehyd
| Analyt | Syringaldehyd | |||||
| Proben | Whisky | Brandy | Rum | Cognac 1 | Bourbon | Cognac 2 |
| Anzahl der teilnehmenden Laboratorien | 16 | 15 | 16 | 16 | 16 | 16 |
| Anzahl berücksichtigter Ergebnisse (Laboratorien) | 13 | 13 | 13 | 12 | 14 | 13 |
| Mittelwert [mg/l] | 1,0 | 0,2 | 4,8 | 3,2 | 10,5 | 9,7 |
| Wiederholstandardabweichung sR [mg/l] | 0,03 | 0,02 | 0,04 | 0,08 | 0,10 | 0,09 |
| Relative Wiederholstandardabweichung, RSDr [%] | 2,6 | 8,1 | 0,8 | 2,6 | 0,9 | 0,9 |
| Wiederholgrenze r [mg/l] (r = 2,8 x sr) |
0,1 | 0,1 | 0,1 | 0,2 | 0,3 | 0,3 |
| Vergleichstandardabweichung sR [mg/l] | 0,08 | 0,07 | 0,23 | 0,19 | 0,39 | 0,43 |
| Relative Vergleichstandardabweichung, RSDR [%] | 8 | 33 | 5 | 6 | 4 | 4 |
| Vergleichgrenze, R [g/l] (R = 2,8 x sR] |
0,2 | 0,2 | 0,7 | 0,5 | 1,1 | 1,2 |
8.6. Coniferaldehyd
| Analyt | Coniferaldehyd | |||||
| Proben | Whisky | Brandy | Rum | Cognac 1 | Bourbon | Cognac 2 |
| Anzahl der teilnehmenden Laboratorien | 13 | 12 | 13 | 12 | 13 | 13 |
| Anzahl berücksichtigter Ergebnisse (Laboratorien) | 12 | 12 | 13 | 12 | 13 | 13 |
| Mittelwert [mg/l] | 0,2 | 0,2 | 0,6 | 0,8 | 4,6 | 1,3 |
| Wiederholstandardabweichung sR [mg/l] | 0,02 | 0,02 | 0,03 | 0,03 | 0,09 | 0,06 |
| Relative Wiederholstandardabweichung, RSDr [%] | 9,2 | 9,8 | 4,6 | 4,3 | 1,9 | 4,5 |
| Wiederholgrenze r [mg/l] (r = 2,8 x sr) |
0,04 | 0,04 | 0,07 | 0,09 | 0,24 | 0,16 |
| Vergleichstandardabweichung sR [mg/l] | 0,04 | 0,04 | 0,11 | 0,18 | 0,38 | 0,25 |
| Relative Vergleichstandardabweichung, RSDR [%] | 23 | 27 | 21 | 23 | 8 | 19 |
| Vergleichgrenze, R [g/l] (R = 2,8 x sR] |
0,1 | 0,1 | 0,3 | 0,5 | 1,1 | 0,7 |
8.7. Sinapaldehyd
| Analyt | Sinapaldehyd | |||||
| Proben | Whisky | Brandy | Rum | Cognac 1 | Bourbon | Cognac 2 |
| Anzahl der teilnehmenden Laboratorien | 14 | 14 | 14 | 14 | 15 | 14 |
| Anzahl berücksichtigter Ergebnisse (Laboratorien) | 14 | 13 | 12 | 13 | 13 | 12 |
| Mittelwert [mg/l] | 0,3 | 0,2 | 0,2 | 1,6 | 8,3 | 0,3 |
| Wiederholstandardabweichung sR [mg/l] | 0,02 | 0,01 | 0,02 | 0,06 | 0,14 | 0,03 |
| Relative Wiederholstandardabweichung, RSDr [%] | 7,5 | 4,6 | 11,2 | 3,7 | 1,6 | 11,4 |
| Wiederholgrenze r [mg/l] (r = 2,8 x sr) |
0,06 | 0,03 | 0,06 | 0,17 | 0,38 | 0,08 |
| Vergleichstandardabweichung sR [mg/l] | 0,09 | 0,05 | 0,08 | 0,20 | 0,81 | 0,18 |
| Relative Vergleichstandardabweichung, RSDR [%] | 31 | 27 | 46 | 13 | 10 | 73 |
| Vergleichgrenze, R [g/l] (R = 2,8 x sR] |
0,2 | 0,2 | 0,2 | 0,6 | 2,3 | 0,5 |
8.8. Gallussäure
| Analyt | Gallussäure | |||||
| Probe | Whisky | Brandy | Rum | Cognac 1 | Bourbon | Cognac 2 |
| Anzahl der teilnehmenden Laboratorien | 16 | 15 | 16 | 16 | 16 | 16 |
| Anzahl berücksichtigter Ergebnisse (Laboratorien) | 15 | 14 | 16 | 16 | 16 | 16 |
| Mittelwert [mg/l] | 1,2 | 0,4 | 2,0 | 6,1 | 7,3 | 21,8 |
| Wiederholstandardabweichung sR [mg/l] | 0,07 | 0,04 | 0,06 | 0,18 | 0,18 | 0,60 |
| Relative Wiederholstandardabweichung, RSDr [%] | 6,1 | 8,1 | 2,9 | 3,0 | 2,4 | 2,8 |
| Wiederholgrenze r [mg/l] (r = 2,8 x sr) |
0,2 | 0,1 | 0,2 | 0,5 | 0,5 | 1,7 |
| Vergleichstandardabwei- chung sR [mg/l] | 0,43 | 0,20 | 0,62 | 3,3 | 2,2 | 7,7 |
| Relative Vergleichstandard- abweichung, RSDR [%] | 36 | 47 | 31 | 53 | 30 | 35 |
| Vergleichgrenze, R [g/l] (R = 2,8 x sR] |
1,2 | 0,6 | 1,7 | 9,1 | 6,2 | 21,7 |
8.9. Ellagsäure
| Analyt | Ellagsäure | |||||
| Proben | Whisky | Brandy | Rum | Cognac 1 | Bourbon | Cognac 2 |
| Anzahl der teilnehmenden Laboratorien | 7 | 7 | 7 | 7 | 7 | 7 |
| Anzahl berücksichtigter Ergebnisse (Laboratorien) | 7 | 7 | 7 | 7 | 7 | 6 |
| Mittelwert [mg/l] | 3,2 | 1,0 | 9,5 | 13 | 13 | 36 |
| Wiederholstandardabweichung sR [mg/l] | 0,20 | 0,16 | 0,30 | 0,41 | 0,95 | 0,34 |
| Relative Wiederholstandardabweichung, RSDr [%] | 6,3 | 16 | 3,2 | 3,2 | 7,4 | 1,0 |
| Wiederholgrenze r [mg/l] (r = 2,8 x sr) |
0,6 | 0,4 | 0,9 | 1,1 | 2,7 | 1,0 |
| Vergleichstandardabweichung sR [mg/l] | 1,41 | 0,42 | 4,0 | 5,0 | 4,9 | 14 |
| Relative Vergleichstandardabweichung, RSDR [%] | 44 | 43 | 42 | 39 | 39 | 40 |
| Vergleichgrenze, R [g/l] (R = 2,8 x sR] |
4,0 | 1,2 | 11 | 14 | 14 | 40 |
8.10. Vanillinsäure
| Analyt | Vanillinsäure | |||||
| Proben | Whisky | Brandy | Rum | Cognac 1 | Bourbon | Cognac 2 |
| Anzahl der teilnehmenden Laboratorien | 15 | 15 | 15 | 15 | 15 | 15 |
| Anzahl berücksichtigter Ergebnisse (Laboratorien) | 12 | 11 | 14 | 14 | 15 | 14 |
| Mittelwert [mg/l] | 0,2 | 0,2 | 1,5 | 0,8 | 2,4 | 2,7 |
| Wiederholstandardabweichung sR [mg/l] | 0,03 | 0,04 | 0,03 | 0,10 | 0,13 | 0,21 |
| Relative Wiederholstandardabweichung, RSDr [%] | 14,2 | 16,5 | 2,3 | 12,6 | 5,3 | 7,7 |
| Wiederholgrenze r [mg/l] (r = 2,8 x sr) |
0,1 | 0,1 | 0,1 | 0,3 | 0,4 | 0,6 |
| Vergleichstandardabweichung sR [mg/l] | 0,06 | 0,05 | 0,51 | 0,2 | 1,22 | 0,70 |
| Relative Vergleichstandardabweichung, RSDR [%] | 28 | 20 | 35 | 31 | 51 | 26 |
| Vergleichgrenze, R [g/l] (R = 2,8 x sR] |
0,2 | 0,1 | 1,4 | 0,7 | 3,4 | 2,0 |
8.11. Syringasäure
| Analyt | Syringasäure | |||||
| Proben | Whisky | Brandy | Rum | Cognac 1 | Bourbon | Cognac 2 |
| Anzahl der teilnehmenden Laboratorien | 16 | 15 | 16 | 16 | 16 | 16 |
| Anzahl berücksichtigter Ergebnisse (Laboratorien) | 16 | 15 | 15 | 15 | 16 | 15 |
| Mittelwert [mg/l] | 0,4 | 0,2 | 2,5 | 1,4 | 3,4 | 4,8 |
| Wiederholstandardabweichung sR [mg/l] | 0,03 | 0,02 | 0,06 | 0,13 | 0,08 | 0,11 |
| Relative Wiederholstandardabweichung, RSDr [%] | 6,7 | 12,6 | 2,3 | 9,0 | 2,3 | 2,3 |
| Wiederholgrenze r [mg/l] (r = 2,8 x sr) |
0,1 | 0,1 | 0,2 | 0,4 | 0,2 | 0,3 |
| Vergleichstandardabweichung sR [mg/l] | 0,08 | 0,05 | 0,29 | 0,26 | 0,43 | 0,67 |
| Relative Vergleichstandardabweichung, RSDR [%] | 19 | 29 | 11 | 18 | 13 | 14 |
| Vergleichgrenze, R [g/l] (R = 2,8 x sR] |
0,2 | 0,1 | 0,8 | 0,7 | 1,2 | 1,9 |
8.12. Scopoletin
| Analyt | Scopoletin | |||||
| Proben | Whisky | Brandy | Rum | Cognac 1 | Bourbon | Cognac 2 |
| Anzahl der teilnehmenden Laboratorien | 10 | 10 | 10 | 10 | 10 | 10 |
| Anzahl berücksichtigter Ergebnisse (Laboratorien) | 9 | 8 | 9 | 8 | 8 | 8 |
| Mittelwert [mg/l] | 0,09 | 0,04 | 0,11 | 0,04 | 0,65 | 0,15 |
| Wiederholstandardabweichung sR [mg/l] | 0,0024 | 0,0008 | 0,0018 | 0,0014 | 0,0054 | 0,0040 |
| Relative Wiederholstandardabweichung, RSDr [%] | 2,6 | 2,2 | 1,6 | 3,3 | 0,8 | 2,7 |
| Wiederholgrenze r [mg/l] (r = 2,8 x sr) |
0,007 | 0,002 | 0,005 | 0,004 | 0,015 | 0,011 |
| Vergleichstandardabweichung sR [mg/l] | 0,01 | 0,01 | 0,03 | 0,01 | 0,09 | 0,02 |
| Relative Vergleichstandardabweichung, RSDR [%] | 15 | 16 | 23 | 17 | 15 | 15 |
| Vergleichgrenze, R [g/l] (R = 2,8 x sR] |
0,04 | 0,02 | 0,07 | 0,02 | 0,26 | 0,06 |
[1] 'Protocol for the Design, Conduct and Interpretation of Method - Performance Studies', Horwitz, W. (1995) Pure and Applied Chemistry 67, 332-343
[2] Horwitz, W. (1982) Analytical Chemistry 54, 67A-76A.
 |
ENDE |  |
(Stand: 25.02.2023)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: 90.- € netto (Grundlizenz)
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion