

 |
zurück |  |
| Bestimmung der Ökotoxizität
Biologische Abbaubarkeit |
Anhang V zur RL 67/548/EWG |
C.10. 1. Methode
C.10. 1.1. Einleitung
C.10. 1.1.1. Allgemeines
Die Methode ist nur für organische Substanzen geeignet, die bei den im Test verwendeten Konzentrationen
Angaben über die relativen Anteile der wichtigsten Bestandteile der Prüfsubstanz sind für die Interpretation der Ergebnisse nützlich, insbesondere wenn die Abbauwerte niedrig oder marginal sind.
Informationen über die Toxizität der Substanz für Mikroorganismen können für die Interpretation niedriger Abbauwerte und die Wahl der geeigneten Prüfkonzentrationen von Nutzen sein.
C.10. 1.1.2. Prüfung der vollständigen biologischen Abbaubarkeit (DOC 1 /CSB 2 -Analyse)
Zweck des Verfahrens ist die Prüfung der vollständigen biologischen Abbaubarkeit organischer Substanzen durch Messung der Abnahme der Prüfsubstanz sowie möglicher Metaboliten in einer Belebtschlamm-Modellanlage bei einer Konzentration von 12 mg DOC/l (oder etwa 40 mg CSB/l). 20 mg DOC/l haben sich als günstig erwiesen.
Der Gehalt der Prüfsubstanz an organischem Kohlenstoff (oder der chemische Sauerstoffbedarf) müssen bekannt sein.
C.10. 1.1.3. Bestimmung der biologischen Primär-Abbaubarkeit (Spezifische Analyse)
Zweck dieses Verfahrens ist die Prüfung der biologischen Primär-Abbaubarkeit einer Substanz in einer Belebtschlamm-Modellanlage bei einer Konzentration von etwa 20 mg Substanz/l unter Verwendung einer substanzspezifischen Analysenmethode (niedrige oder höhere Konzentrationen können eingesetzt werden, wenn die analytische Methode und die Toxizität dies erlauben). Dieses Verfahren ermöglicht die Beurteilung der Primär-Abbaubarkeit der Substanz (Verschwinden der ursprünglichen chemischen Struktur).
Es ist nicht Zweck dieses Verfahrens, die Mineralisierbarkeit der Prüfsubstanz zu bestimmen.
Für die quantitative Analyse der Prüfsubstanz muß ein geeignetes Verfahren zur Verfügung stehen.
1.2. Definitionen und Einheiten
1.2.1. DOC/CSB-Analyse
Die Abnahme der Substanz ist gegeben durch
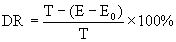 [1a)]
[1a)]
Darin sind:
| DR = | DOC- (oder CSB-)Abnahme in % bei der gegebenen mittleren Verweilzeit, bezogen auf die eingesetzte Prüfsubstanz, |
| T = | Konzentration der Prufsubstanz im Zulauf in mg DOC/l (oder mg CSB/l), |
| E = | DOC- (oder CSB-)Konzentration im Ablauf in mg/l, |
| E0= | DOG- (oder CSB-)Konzentration im Ablauf der Kontrollanlage in mg/l. |
Als Abbau wird die prozentuale DOC- (oder CSB-)Abnahme bei der gegebenen Verweilzeit, bezogen auf die eingesetzte Prüfsubstanz, angegeben.
C.10. 1.2.2. Spezifische Analyse
Die prozentuale Elimination der Prüfsubstanz aus der wäßrigen Phase (Rw) innerhalb der gegebenen mittleren Verweilzeir ist gegeben durch
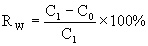 [1 b)]
[1 b)]
Darin sind:
| C1= | Konzentration der Prüfsubstanz im Zulauf der Prüfanlage (mg Substanz/l, bestimmt durch spezifische Analyse), |
| C0 = | Konzentration der Prüfsubstanz im Ablauf der Prüfanlage (mg Substanz/l), bestimmt durch spezifische Analyse). |
C.10. 1.3. Referenzsubstanzen
Wenn eine neue Substanz untersucht wird, sind Referenzsubstanzen in manchen Fällen nützlich. Hier kann jedoch noch keine bestimmte Substanz empfohlen werden.
C.10. 1.4. Prinzip der Methoden
Um die vollständige biologische Abbaubarkeit zu prüfen, sind zwei Belebtschlamm-Modellanlagen (OECD Confirmatory Test-Einheit oder "Porous por"), die parallel betrieben werden, erforderlich. Die Prüfsubstanz wird dem Zulauf (synthetisches oder kommunales Abwasser) einer der beiden Anlagen zugesetzt, während die andere Anlage nur das Abwasser erhält.
Um die biologische Primär-Abbaubarkeit mit Hilfe spezifischer Analysen der Prüfsubstanz im Zu- und Ablauf zu bestimmen, ist nur eine Anlage erforderlich.
Die DOC- (oder CSB-)Konzentrationen werden in den Abläufen gemessen, oder es werden die Konzentrationen der Prüfsubstanz über die spezifische Analyse bestimmt.
Der Gesamt-DOC-Gehalt der Nährlösung (Abwasser u. Prüfsubstanz) muß nicht gemessen, sondern kann als Summe der beiden Einzelwerte angegeben werden.
Bei DOC- (oder CSB-)Messungen geht man davon aus, daß die Differenz der Konzentrationen zwischen Prüf- und Kontrollablauf auf nicht abgebaute Prüfsubstanz beruht.
Mit Hilfe spezifischer Analysen läßt sich die Änderung der Konzentration der Ausgangssubstanz messen (biologischer Primär-Abbau).
Die Anlagen können nach einem Überimpfungsverfahren gekoppelt betrieben werden.
C.10. 1.5. Qualitätskriterien
Die Ausgangskonzentration der Prüfsubstanz ist unter Berücksichtigung der Art der Analyse und ihrer jeweiligen Erfassungsgrenze zu wählen.
C.10. 1.6. Beschreibung des Prüfverfahrens
C.10. 1.6.1. Vorbereitung
C.10. 1.6.1.1. Geräte
Wenn nicht mit spezifischer Analytik gearbeitet wird, werden zwei Modellanlagen gleichen Typs benötigt. Zwei Anlagetypen stehen zur Verfügung, die wahlweise eingesetzt werden können:
OECD-Confirmatory-Test-Anlage
Die Anlage besteht aus einem Vorratsgefäß (A) für das Abwasser, einer Dosierpumpe (B), einem Belüftungsgefäß (C), einem Absetzgefäß (D), einem Druckluftheber (E) zur Rückführung des Belebtschlamms sowie einem Sammelgefäß für den behandelten Ablauf (F).
Die Gefäße a und F müssen aus Glas oder geeignetem Kunststoff bestehen und mindestens 24 Liter fassen. Die Pumpe (B) muß einen konstanten Zustrom des Abwassers zum Belüftungsgefäß erlauben. Jedes geeignete System, das einen bestimmten Zustrom sowie eine bestimmte Konzentration gewährleistet, kann eingesetzt werden.
Bei normalem Betrieb wird die Höhe des Absetzgefäßes (D) so eingestellt, daß das Volumen der Kultursuspension im Belüftungsgefäß 3 Liter beträgt. In der kegelförmigen Spitze des Belüftungsgefäßes befindet sich ein gesinterter, poröser Stein zur Belüftung. Die Belüftungsrate muß mit Hilfe eines Durchflußmessers kontrolliert werden. Der Druckluftheber (E) ist so eingestellt, daß der Belebtschlamm kontinuierlich und regelmäßig vom Absetzgefäß in das Belüftungsgefäß zurückgeführt wird.
"Porous pot"-Anlage
Der "Porous por" ist folgendermaßen konstruiert: Poröse Polyethylenfolien (Dicke: 2 mm; max. Porengröße: 95 µ) bilden einen Zylinder (∅ :14 cm) mit einem konischen Ende (45°) (siehe Abbildung 1 und 2 in Anlage 2). Der "Porous pot" befindet sich in einem undurchlässigen Gefäß (∅ 15 cm) aus geeignetem Kunststoff, das in seinem zylindrischen Teil in der Höhe von 17,2 cm bei einem Volumen vom 3 Liter einen Auslaß aufweist. Am oberen Ende des Innengefäßes ist ein starrer Halterungsring aus Kunststoff so angebracht, daß zwischen Außen- und Innengefäß 0,5 cm Ablaufraum liegen. Der "Porous pot" kann in ein durch einen Thermostaten kontrolliertes Wasserbad montiert werden, Über eine Luftzufuhr zum Boden des Innengefäßes wird mit Hilfe eines geeigneten Verteilers belüftet.
Die Gefäße (A) und (E) müssen aus Glas oder einem geeigneten Kunststoff bestehen und mindestens 24 Liter fassen. Die Pumpe (B) muß einen konstanten Zustrom des Abwassers in das Belüftungsgefäß erlauben. Jedes geeignete System kann verwendet werden, vorausgesetzt, daß ein bestimmter Zustrom und eine bestimmte Konzentration gewährleistet sind.
Zusätzliche "Porous-pot"-Gefäße sind erforderlich, damit ein Gefäß, das während des Gebrauchs verstopft ist, ersetzt werden kann. Verstopfte Gefäße werden 24 Stunden in Hypochloritlösung gelegt und anschließend gründlich mit Leitungswasser gespült.
C.10. 1.6.1.2. Filtration
Es sind Membranfiltrarionsgeräte und Membranfilter (Porengröße: 0,45 µm) erforderlich. Die Membranfilter dürfen weder Kohlenstoff freisetzen noch die Substanz beim Filtrieren adsorbieren.
C.10. 1.6.1.3. Abwasser
Es kann wahlweise geeignete synthetische Nährlösung oder kommunales Abwasser verwendet werden.
Beispiel für synthetische Nährlösung
Pro Liter Leitungswasser sind zu lösen:
| Pepron: | 160 mg, |
| Fleischextrakt: | 110 mg, |
| Harnstoff: | 30 mg, |
| NaCI: | 7 mg, |
| CaCI2 ξ 2H2O: | 4 mg, |
| MgSO4 ξ 7H2O: | 2 mg, |
| K2HPO4: | 28 mg. |
Häusliches Abwasser
Es ist jeden Tag frisch vom Überlauf der mechanischen Stufe einer Kläranlage, die hauptsächlich kommunale Abwässer reinigt, zu entnehmen.
C.10. 1.6.1.4. Stammlösung der Prüfsubstanz
Es wird eine Lösung der Prüfsubstanz, z.B. 1 %ig, angesetzt. Die Konzentration der Prüfsubstanz muß bestimmt werden, um ein geeignetes Volumen zur Einstellung der erforderlichen Prüfkonzentration in der Kultursuspension ermitteln zu können. Dies wird dann entweder dem Abwasser zugesetzt oder kontinuierlich über eine zweite Pumpe direkt in das Belüftungsgefäß gegeben.
C.10. 1.6.1.5. Inokulum
Anmerkung: Wird kommunales Abwasser verwendet, ist es wenig zweckmäßig, ein Inokulum mit geringer Bakterienkonzentration zu wählen; hier ist Belebtschlamm einzusetzen.
Es können Inokula verschiedener Herkunft eingesetzt werden.
Hier werden drei Beispiele für geeignetes Impfgut angegeben:
a) Inokulum aus Kläranlagenablauf
Das Inokolum wird vorzugsweise dem Ablauf einer gut arbeitenden Kläranlage, in der hauptsächlich kommunale Abwässer gereinigt werden, entnommen. Die Suspension muß zwischen Probenahme und Verwendung aerob gehalten werden. Zur Aufbereitung des Inokulums wird die Probe durch ein grobes Filter gegeben, wobei die ersten 200 ml verworfen werden. Das Filtrat wird bis zur Verwendung aerob gehalten. Das lmpfgut muß am gleichen Tag verwendet werden. Zur Beimpfung müssen mindestens 3 ml eingesetzt werden:
b) Misch-Inokulum
Inokulum aus einem Kläranlagenablauf:
Siehe oben.
Inokulum aus Boden:
100 g Gartenboden (fruchtbarer, nicht steriler Boden) werden in 1 Liter chlorfreiem Trinkwasser suspendiert. (Böden mit sehr hohem Gehalt an Ton, Sand oder Humus sind ungeeignet.) Nach dem Umrühren läßt man die
Suspension für 30 Minuten absetzen. Der Überstand wird durch ein großes Filter gegeben, wobei die ersten 200 ml verworfen werden. Das Filtrat wird sofort und bis zur Verwendung belüftet. Das Inokulum muß am gleichen Tag verwendet werden.
Inokulum aus Oberflächenwasser
Ein weiterer Anteil des Mischinokulums wird von einem mesosaprobischen Oberflächenwasser gewonnen. Die Probe wird durch ein grobes Filter gegeben, wobei die ersten 200 ml verworfen werden. Bis zur Verwendung wird das Filtrat aerob gehalten. Das Inokulum muß am gleichen Tag verwendet werden.
Die drei verschiedenen Impfsuspensionen werden zu gleichen Teilen gut gemischt. Mindestens 3 ml dieser Suspension sind für die Beimpfung einzusetzen.
c) Inokulum aus Belebtschlamm
Ein Volumen von nicht mehr als 3 Liter Belebtschlamm (Gehalt an suspendierten Feststoffen bis zu 2,5 g/l) vom Belüftungsbecken einer Kläranlage, die hauptsächlich kommunales Abwasser reinigt, wird als Inokulum verwendet.
C.10.1.6.2. Prüfverfahren
Der Test wird bei einer Raumtemperatur von 180 °C bis 250 °C durchgeführt. Gegebenenfalls kann der Test bei einer niedrigeren Temperatur (bis zu 10 °C) durchgeführt werden: Wenn die Prüfsubstanz unter diesen Bedingungen abgebaut wird, sind normalerweise keine weiteren Untersuchungen erforderlich. Wird die Substanz jedoch nicht abgebaut, muß der Test bei 18 bis 250 °C wiederholt werden.
C.10. 1.6.2.1. Anlaufphase: Schlammbildung/Stabilisierung der Anlagen
Die Schlammwachstums-/Srabilisierungsphase ist der Zeitraum, in dem die Konzentration der im Belebtschlamm suspendierten Feststoffe und der Betrieb der Anlagen bei den gegebenen Betriebsbedingungen ein Fließgleichgewicht erreichen.
Die Anlaufphase ist der Zeitraum beginnend mit der ersten Zugabe der Prüfsubstanz bis zu dem Zeitpunkt, zu dem ihre Abnahme ein Plateau erreicht (d. h. ein verhältnismäßig konstanter Wert gemessen wird). Dieser Zeitraum darf sechs Wochen nicht überschreiten.
Die Auswertungsphase ist ein Zeitraum von drei Wochen, beginnend drei Wochen nachdem die Abnahme der Prüfsubstanz einen relativ konstanten und gewöhnlich hohen Wert erreicht hat: Für Substanzen, die in den ersten sechs Wochen wenig oder gar nicht abgebaut werden, werden die darauffolgenden drei Wochen als Auswertungsphase gewählt.
Zunächst wird in die für den Test vorgesehene Anlage (oder die Anlagen) das mit Abwasser gemischte Inokulum gefüllt. Dann wird die Belüftung (und bei Verwendung der OECD-Confirmatory-Test-Anlage) durch Mammutpumpe sowie das Dosiergerät in Betrieb gesetzt.
Der Zulauf (Abwasser) ohne Prüfsubstanz muß das Belüftungsgefäß entweder mit einer Rate von 1 Liter/Std. oder von 1/2 Liter/Std. durchfließen; dies ergibt eine mittlere Verweilzeit von drei bzw. sechs Stunden.
Die Belüftung muß so reguliert sein, daß der Inhalt im Belüftungsgefäß immer in Suspension ist und der Gehalt an gelöstem Sauerstoff mindestens 2 mg/l beträgt.
Ein Schäumen muß mit geeigneten Mitteln verhindert werden. Antischäummittel, die den Belebtschlamm hemmen, dürfen nicht eingesetzt werden.
Schlamm, der sich am oberen Ende der Belüftungsgefäße (und im Falle der "OECD-Confirmatory Test"-Anlage am Boden des Absetzgefäßes sowie im Rücklaufsystem) angesammelt hat, muß mindestens einmal täglich durch Bürsten oder andere geeignete Maßnahmen in die Kultursuspension zurückgeführt werden.
Wenn der Schlamm sich nicht absetzt, kann seine Dichte durch Zugabe von 2 ml einer 5 %igen Eisen(III)chloridlösung erhöht werden; dies wird so oft wie nötig wiederholt.
Der Ablauf wird 20 bis 24 Stunden lang in den Gefäßen (E) oder (F) gesammelt; bevor eine Probe genommen wird, muß gründlich gemischt werden. Die Gefäße (E) oder (F) sind sorgfältig zu reinigen.
Um die Effektivität des Verfahrens zu verfolgen und zu kontrollieren, werden CSB oder DOC des Filtrats vom gesammelten Ablauf mindestens zweimal wöchentlich gemessen. Ebenso werden CSB und DOC des filtrierten Zulaufs bestimmt. Zur Filtration werden Membranfilter, Porengröße 0,45 µm benutzt; die jeweils ersten 20 ml des Filtrats werden verworfen.
Die Differenz im CSB- oder DOC-Gehalt aufeinanderfolgender Messungen wird geringer, wenn sich der Abbauprozeß stabilisiert.
Der Trockensubstanzgehalt (in g/l) des Belebtschlamms im Belüftungsgefäß sollte ebenfalls zweimal wöchentlich bestimmt werden. Die Anlagen können nach zweierlei Arbeitsweisen betrieben werden: Entweder wird der Trockensubstanzgehalt des Belebtschlamms zweimal wöchentlich bestimmt (falls er höher als 2,5 g/l liegt, muß der überschüssige Belebtschlamm verworfen werden) oder es werden täglich 500 ml der Kultursuspension aus den Belüftungsgefäßen entfernt, so daß sich für den Schlamm eine mittlere Verweilzeit von sechs Tagen ergibt.
Wenn die gemessenen und geschätzten Parameter (dies sind: Effektivität des Verfahrens (CSB- oder DOC-Abnahme, Schlammkonzentration, Absetzbarkeit des Schlamms, Trübung des Überstands usw.) der beiden Anlagen ausreichend stabil sind, kann die Prüfsubstanz, wie unter 1.6.2.2 beschrieben, in den Zulauf einer der beiden Anlagen gegeben werden.
Alternativ kann die Prüfsubstanz zu Beginn der Schlammwachstumsphase (1.6.2.1.) hinzugefügt werden, insbesondere dann, wenn Belebtschlamm als Inokulum eingesetzt wird.
C.10. 1.6.2.2. Prüfverfahren
Unter Einhaltung der Betriebsbedingungen der Anlaufphase wird die Stammlösung der Prüfsubstanz (etwa 1 %ig) dem Zulauf der Prüfanlage zugesetzt, so daß die Substanz in der gewünschten Konzentration vorliegt (etwa 10-20 mg DOC/l oder 40 mg CSB/l).
Die Stammlösung kann hierfür entweder täglich dem Abwasser beigemischt oder mittels eines getrennten Pumpsystems der Kultursuspension zugesetzt werden. Die Konzentration kann schrittweise bis zur gewünschten Konzentration erhöht werden. Wenn die Prüfsubstanz auf den Belebtschlamm nicht toxisch wirkt, können auch höhere Konzentrationen als oben angegeben geprüft werden.
In die Kontrollanlage wird nur Abwasser, aber keine Prüfsubstanz gegeben. Vom Ablauf werden geeignete Mengen für die Analyse entnommen und membranfiltriert (Porengröße 0,45 µm), wobei die ersten 20 ml des Filtrats verworfen werden.
Die filtrierten Proben müssen entweder am gleichen Tag analysiert oder bis zur Analyse durch geeignete Methoden konserviert werden (z.B. durch 0,05 ml einer 1 %igen Quecksilberchloridlösung! 10 ml Filtrat oder indem sie bei 2 bis 4 °C bis zu 24 Stunden oder bei -18 °C für längere Zeit aufbewahrt werden).
Die Anlaufphase ab Zugabe der Prüfsubstanz sollte sechs Wochen nicht überschreiten; die Auswertungsphase sollte nicht kürzer als drei Wochen sein, so daß 14 bis 20 Bestimmungen für die Berechnung des Endergebnisses zur Verfügung stehen.
Gekoppelte Anlagen
Die Anlagen werden gekoppelt, indem 1 x täglich 2,5 Liter der Kultursuspension (einschl. Schlamm) aus den Belüftungsgefäßen zwischen den beiden Anlagen ausgetauscht werden. Wenn die Prüfsubstanz stark adsorbiert, werden 1,5 Liter des Überstands aus den Absetzgefäßen entnommen und jeweils in das Belüftungsgefäß der anderen Anlage gegeben.
C.10. 1.6.2.3. Analytik
Um das Verhalten der Prüfsubstanz zu verfolgen, werden zwei Arten von Analysen durchgeführt:
DOC- und CSB-Analysen
Die DOC-Konzentrationen werden in doppelter Ausführung mit einem Kohlenstoffanalysator gemessen und/oder die CSB-Werte nach Lit. 2 bestimmt.
Spezifische Analyse
Die Konzentrationen der Prüfsubstanz werden mit einer geeigneten analytischen Methode bestimmt. Wenn möglich, soll auch die an den Schlamm adsorbierte Substanz erfaßt werden.
C.10. 2. Daten und Auswertung
C.10. 2.1. Gekoppelte Anlagen
Wird das Verfahren mit gekoppelten Anlagen angewandt, ist die prozentuale Abnahme (DR) gemäß C.10.1.2.1 täglich zu berechnen.
Diese täglich berechneten Werte der Abnahme werden zu DRc korrigiert, da die Übertragung von Material durch die Überimpfung zu berücksichtigen ist. Dies erfolgt nach Gleichung [2] für eine mittlere Aufenrhaltszeit von drei Stunden und nach Gleichung [3] für eine mittlere Retentionszeit von sechs Stunden.
DRc = 8/7 DR - 100/7 [2]
DRc = 4/3 DR - 100/3 [3]
Der Mittelwert der Reihe von DRc-Werten wird errechnet, die Standardabweichung ergibt sich nach Gleichung [4]
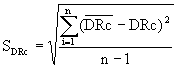 [4]
[4]
Darin sind:
| SDRc | = Standardabweichung der Reihe von DRc-Werten, |
 c c |
= Mittelwert der DRc-Werte, |
| n | = Anzahl der Bestimmungen. |
Ausreißer in der Reihe der DRc-Werte werden nach geeigneten statistischen Verfahren, z.B. nach Nalimov [6], bei einer statistischen Sicherheit von 95 % eliminiert; Mittelwert und Standardabweichung werden aus den ausreißerfreien DRc-Daten neu berechnet:
Das Endresultat wird dann mit der Gleichung [5] errechnet.
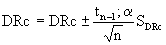 [5]
[5]
Darin sind:
| tn-1;α = | Tabellenwert von t für n Wertepaare von e und E0 und einem statistischen Vertrauensbereich P (P = 1 -α ), wobei P = 95 % gesetzt wird (1). |
Als Ergebnis wird der Mittelwert mit einer Sicherheit von 95 %, die jeweilige Standardabweichung, die Anzahl an Daten der ausreißerfreien DRc-Werte sowie die Anzahl der Ausreißer angegeben.
Beispiel:
| DRc | = 98,6 ± 2,3 % DOC-Abnahme, |
| s | = 4,65 % DOC-Abnahme, |
| n | = 18, |
| x | = Anzahl der Ausreißer. |
C.10 2.2. Nicht gekoppelte Anlagen
Die Betriebsleistung der Anlagen kann folgendermaßen überprüft werden:
| % Abnahme des CSB oder DOC = | CSB oder DOC des Abwassers - CSB oder DOC des Ablaufs | x 100 |
| CSB oder DOC des Abwassers |
Wenn die täglich gemessene Abnahme graphisch dargestellt wird, werden alle Trends, z.B. eine Adaptation, verdeutlicht.
C.10. 2.2.1. Verfahren mit CSB/DOC-Bestimmungen
Die täglich gemessene prozentuale Abnahme DR wird gemäß 1.2.1 berechnet. Der Mittelwert der Reihe von DR-Werten wird errechnet; die Standardabweichung ergibt sich nach [6]
 [6]
[6]
Darin sind:
| SDR | = Standardabweichung der Reihe von DR1-Werten, |
 |
= Mittelwert der DR1-Werte, |
| n | = Anzahl der Bestimmungen. |
Ausreißer in der Reihe der DR-Werte werden nach geeigneten statistischen Verfahren, z.B. nach Nalimov [6], bei einer statistischen Sicherheit von 95 % eliminiert; Mittelwert und Standardabweichung werden aus den ausreißerfreien DR-Daten neu berechnet.
Das Endresultat wird dann mit der Gleichung [7] errechnet.
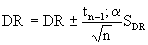 [7]
[7]
Darin sind:
| tn-1;α = | Tabellenwert von t für n Wertepaare von E und E0 und einem statistischen Vertrauensbereich P (P = 1-α ), wobei P = 95 % gesetzt wird (1). |
Als Ergebnis wird der Mittelwert mit Toleranzgrenzen bei einer statistischen Sicherheit von 95 %, die jeweilige Standardabweichung und die Anzahl an Daten der ausreißerfreien DR-Werte sowie die Anzahl der Ausreißer angegeben.
Beispiel:
| DR | = (98,6 ± 2,3 %) DOC-Abnahme, |
| s | = 4,65% DOC-Abnahme, |
| n | = 18, |
| x | = Anzahl der Ausreißer. |
C.10. 2.2.2. Verfahren mit spezifischer Analyse
Die Eliminierung der Prüfsubstanz in % aus der wäßrigen Phase (Rw) wird gemäß 1.2.2 berechnet.
C.10. 3. Abschlußbericht
C.10. 3.1. Prüfbericht
Im Prüfbericht ist, wenn möglich, folgendes anzugeben:
C.10. 3.2. Interpretation der Ergebnisse
Ursache für eine geringe Abnahme der Prüfsubstanz in der wäßrigen Phase kann eine Hemmung der Mikroorganismen durch die Prüfsubstanz sein. Dies kann sich auch an einer Schlammauflösung und an einem Schlammverlust zeigen, was zu einem trüben Überstand sowie zu einer abnehmenden Effektivität der CSB- oder DOC-Abnahme in der Anlage führt.
Physikochemische Adsorption kann manchmal eine Rolle spielen. Zwischen biologischem Abbau des Moleküls und physikochemischer Adsorption kann unterschieden werden, wenn der Schlamm nach einer Desorption analysiert wird.
Soll zwischen vollständigem (oder teilweisem) biologischen Abbau und Adsorption unterschieden werden, sind weitere Tests erforderlich. Hierfür bieten sich mehrere Möglichkeiten an; am besten verwendet man jedoch den Überstand aus dem Absetzgefäß als Inokulum in einem Grundstufen-Test (vorzugsweise mit respiratorischer Messung).
Hohe DOC- oder CSB-Abnahmen werden in der Regel durch biologischen Abbau verursacht; bei geringer Abnahme kann dagegen nicht zwischen biologischem Abbau und Elimination und Adsorption unterschieden werden. Zeigt beispielsweise eine lösliche Verbindung eine hohe Adsorptionsrate von 98 % und werden täglich 10 % des Überschußschlammes entfernt, so ist allein hierdurch eine Elimination bis zu 40 % möglich. Werden täglich 30 % des Überschußschlammes entfernt, kann die Elimination aufgrund der Adsorption an und der Entfernung mit Überschußschlamm auf 65 % steigen (4).
Bei spezifischen Analysen muß darauf geachtet werden, welche Bedeutung die Struktur der Substanz für die eingesetzte spezifische Analyse hat. Eine Abnahme der Substanz, bestimmt durch spezifische Analyse, kann nicht als Mineralisierung der Substanz interpretiert werden.
C.10. 4. Literatur
(1) OECD, Paris 1981, Test Guideline 303 A, Beschluß des Rates C(81)30 final.
(2) Anhang V; C.6; Abbaubarkeit - Chemischer Sauerstoffbedarf
(3) H. A. Painter and E. F. King, WRC Porous Pot method for assessing biodegradability. Technical Report TR7O. June 1978, Water Research center, Vereinigtes Königreich.
(4) Wierich P., and Gerike P., The Fate of Soluble, Recalcitrant, and Absorbing Compounds in Activated Sludge Plants - Ecotoxicology and Environmental Safety, Vol 5, Nr. 2 - June 1981, S. 161 bis 171.
(5) Richtlinien 82/242/EWG und 82/243/EWG des Rates (Amtsblatt der Europäischen Gemeinschaften Nr. L 109 vom 22.04.1982), zur Anpassung der Richtlinien 73/404/EWG und 73/405/EWG des Rates - Biodegradability of detergents - Amtsblatt der Europäischen Gemeinschaften Nr. L 347 vom 17.12.1973.
(6) Streuli, H., Fehlerhafte Interpretation und Anwendung von Ausreißertests, insbesondere bei Ringversuchen zur Überprüfung analytisch-chemischer Untersuchungsmethoden, Fresenius-Zeitschrift für Analytische Chemie 303 (1980), S. 406 bis 408.
Anlage 1
zur RL 67/548/EWG Anhang V C.10.
Anlage 2
zur RL 67/548/EWG Anhang V C.10.
Anlage 3
zur RL 67/548/EWG Anhang V C.10.
Betriebsbedingungen des Simulationssests mit Belebtschlamm
In jeder Gruppe durchgeführte Kontrollen
| Anlage | |
| OECD Confirmatory | _______ |
| Porous Por | _______ |
| Betriebsweise | |
| einzelne Anlage | _______ |
| gekoppelte Anlage | _______ |
| nicht gekoppelte Anlage | _______ |
| Überimpfung | |
| keine | _______ |
| Belebtschlamm | _______ |
| Überstand | _______ |
| Mittlere Verweilzeit | _______ |
| 3 Stunden | _______ |
| 6 Stunden | _______ |
| Ausgangsnährmedium | |
| kommunales Abwasser | _______ |
| synthetisches Abwasser | _______ |
| Inokulum | |
| Kläranlagenablauf | _______ |
| Mischinokulum | _______ |
| Belebtschlamm | _______ |
| Zugabe der Prüfsubstanz | |
| bei Beginn | _______ |
| schrittweiser Anstieg | _______ |
| nach der Schlammbildung | _______ |
| Analysen | |
| spezifisch | _______ |
| CSB | _______ |
| DOC | _______ |
 |
weiter . |  |
1) DOC = Dissolved Organic Carbon = Gelöster organischer Kohlenstoff.
2) CSB = Chemischer Sauerstoffbedarf.
(Stand: 04.08.2022)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: ab 105.- € netto
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion