 Für einen individuellen Ausdruck passen Sie bitte die
Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 1964, Lebensmittel/Futtermittel - EU Bund

 Für einen individuellen Ausdruck passen Sie bitte die Für einen individuellen Ausdruck passen Sie bitte dieEinstellungen in der Druckvorschau Ihres Browsers an. Regelwerk, EU 1964, Lebensmittel/Futtermittel - EU Bund |
 |
Richtlinie 64/432/EWG des Rates vom 26. Juni 1964 zur Regelung viehseuchenrechtlicher Fragen beim innergemeinschaftlichen Handelsverkehr mit Rindern und Schweinen
(ABl. Nr. L 121 vom 29.07.1964 S. 1977, ber. P 176 S. 2799, ber. 1977 L 64 S. 28, ber. 1981 L 25 S. 26, ber. L 49 S. 16, ber. L 329 S. 22, ber. 1982 L 192S. 23, ber. 1985 L 42 S. 20, ber. L 133 S. 32, ber. 1998 L 73 S. 51, ber. L 79S. 28, ber. 2014 L 329 S. 81;
RL 66/600/EWG - 192 vom 27.10.1966 S. 3294;
RL 70/360/EWG - ABl. Nr. L 157 vom 18.07.1970 S. 40;
RL 71/285/EWG - ABl. Nr. L 179 vom 09.08.1971 S. 1;
RL 72/97/EWG - ABl. Nr. L 38 vom 12.02.1972 S. 95;
Beitrittsakte Dänemarks, Irlands, des Vereinigten Königreichs Großbritannien und Nordirland - ABl. Nr. L 73 vom 27.03.1972 S. 14;
RL 72/445/EWG - ABl. Nr. L 298 vom 31.12.1972 S. 49;
RL 72/462/EWG - ABl. Nr. L 302 vom 31.12.1972 S. 28;
(angepaßt durch den Beschluß des Rates von 1. Januar 1973) - ABl. Nr. L 2 vom 01.01.1973 S. 1;
RL 73/150/EWG - ABl. Nr. L 172 vom 28.06.1973 S. 18;
RL 74/387/EWG - ABl. Nr. L 202 vom 24.07.1974 S. 36;
RL 75/379/EWG - ABl. Nr. L 172 vom 03.07.1975 S. 17;
RL 77/98/EWG - ABl. Nr. L 26 vom 31.01.1977 S. 81;
RL 79/109/EWG - ABl. Nr. L 29 vom 03.02.1979 S. 20;
RL 79/111/EWG - ABl. Nr. L 29 vom 03.02.1979 S. 26;
Beitrittsakte Griechenlands - ABl. Nr. L 291 vom 19.11.1979 S. 17;
RL 80/219/EWG - ABl. Nr. L 47 vom 21.02.1980 S. 25;
RL 80/1098/EWG - ABl. Nr. L 325 vom 01.12.1980 S. 11;
RL 80/1102/EWG - ABl. Nr. L 325 vom 01.12.1980 S. 18;
RL 85/571/EWG - ABl. Nr. L 372 vom 31.12.1985 S. 12;
RL 80/1274/EWG - ABl. Nr. L 375 vom 31.12.1980 S. 75;
RL 81/476/EWG - ABl. Nr. L 186 vom 08.07.1981 S. 20;
RL 82/61/EWG - ABl. Nr. L 29 vom 06.02.1982 S. 13;
RL 82/893/EWG - ABl. Nr. L 378 vom 31.12.1982 S. 57;
RL 83/646/EWG - ABl. Nr. L 360 vom 23.12.1983 S. 44;
RL 84/336/EWG - ABl. Nr. L 177 vom 04.07.1984 S. 22;
RL 84/643/EWG - ABl. Nr. L 339 vom 27.12.1984 S. 27;
RL 84/644/EWG - ABl. Nr. L 339 vom 27.12.1984 S. 30;
RL 85/320/EWG - ABl. Nr. L 168 vom 28.06.1985 S. 36;
RL 85/586/EWG - ABl. Nr. L 372 vom 31.12.1985 S. 44;
VO (EWG) Nr. 3768/85 - ABl. Nr. L 362 vom 31.12.1985 S. 8;
Entsch. 87/231/EWG - ABl. Nr. L 99 vom 11.04.1987 S. 18;
RL 87/489/EWG - ABl. Nr. L 280 vom 03.10.1987 S. 28;
RL 88/406/EWG - ABl. Nr. L 194 vom 22.07.1988 S. 1;
RL 89/360/EWG - ABl. Nr. L 153 vom 06.06.1989 S. 29;
RL 89/662/EWG - ABl. Nr. L 395 vom 30.12.1989 S. 13;
RL 90/422/EWG - ABl. Nr. L 224 vom 18.08.1990 S. 9;
RL 90/423/EWG - ABl. Nr. L 224 vom 18.08.1990 S. 13;
RL 90/425/EWG - ABl. Nr. L 224 vom 18.08.1990 S. 29;
RL 91/499/EWG - ABl. Nr. L 268 vom 24.09.1991 S. 107;
RL 91/687/EWG - ABl. Nr. L 377 vom 31.12.1991 S. 16;
RL 92/65/EWG - ABl. Nr. L 268 vom 14.09.1992 S. 54;
RL 92/102/EWG - ABl. Nr. L 355 vom 05.12.1992 S. 32;
RL 94/42/EG - ABl. Nr. L 201 vom 04.08.1994 S. 26;
Beitrittsakte Österreichs, Finnlands und Schwedens - ABl. C 241 vom 29.08.1994 S. 21;
(angepaßt durch den Beschluß 95/1/EG, Euratom, EGKS des Rates) - ABl. Nr. L 1 vom 01.01.1995 S. 1;
RL 95/25/EG - ABl. Nr. L 243 vom 11.10.1995 S. 16;
RL 97/12/EG - ABl. Nr. L 109 vom 25.04.1997 S. 1;
RL 98/99/EG - ABl. Nr. L 358 vom 31.12.1998 S. 107;
RL 98/46/EG - ABl. Nr. L 198 vom 15.07.1998 S. 22;
RL 2000/15/EG - ABl. Nr. L 105 vom 03.05.2000 S. 34;
RL 2000/20/EG - ABl. Nr. L 163 vom 04.07.2000 S. 35;
Entsch. 2001/298/EG - ABl. Nr. L 102 vom 12.04.2001 S. 63;
VO (EG) 535/2002 - ABl. Nr. L 80 vom 23.03.2002 S. 22;
VO (EG) 1226/2002 - ABl. Nr. L 179 vom 09.07.2002 S. 13;
Akte 2003 - ABl. Nr. L 236 vom 23.09.2003 S. 33;
VO(EG) 21/2004 - ABl. Nr. L 5 vom 09.01.2004 S. 8, ber. 2016 L 116 S. 39;
VO(EG) 1/2005 - ABl. Nr. L 3 vom 05.01.2005 S. 1;
Entsch. 2006/911/EG - ABl. Nr. L 346 vom 09.12.2006 S. 41;
RL 2006/104/EG - ABl. Nr. L 363 vom 20.12.2006 S. 352;
Entsch. 2007/729/EG - ABl. Nr. L 294 vom 13.11.2007 S. 26;
RL 2008/73/EG - ABl. Nr. L 219 vom 14.08.2008 S. 40;
Entsch. 2008/984/EG - ABl. Nr. L 352 vom 31.12.2008 S. 38;
Beschl. 2009/976/EU - ABl. Nr. L 336 vom 18.12.2009 S. 36;
RL 2013/20/EU - ABl. Nr. L 158 vom 10.06.2013 S. 234;
RL 2014/64/EU - ABl. Nr. L 189 vom 27.06.2014 S. 161;
Beschl. 2014/798/EU - ABl. Nr. L 330 vom 15.11.2014 S. 50;
RL 2014/64/ EU - ABl. Nr. L 189 vom 27.06.2014Anwenden;
Beschl. 2015/819 - ABl. Nr. L 129 vom 27.05.2015 S. 28;
VO (EU) 2016/429 - ABl. Nr. L 84 vom 31.03.2016 S. 1 Inkrafttreten/Gültigaufgehoben)
aufgehoben/ersetzt gem. Art. 270 der VO (EU) 2016/429
Der Rat der Europäischen Wirbschaftsgemeinschaft -
gestützt auf den Vertrag zur Gründung der Europäischen Wirtschaftsgemeinschaft, insbesondere auf die Artikel 43 und 100,
auf Vorschlag der Kommission,
nach Stellungnahme des Europäischen Parlaments 1, nach Stellungnahme des Wirtschafts- und Sozialausschusses 2,
in Erwägung nachstehender Gründe:
Die Verordnung Nr. 20 des Rates über die schrittweise Errichtung einer gemeinsamen Marktorganisation für Schweinefleisch 3 wird bereits angewendet; die Verordnung Nr. 14/64/EWG des Rates über die schrittweise Errichtung einer gemeinsamen Marktorganisation für Rindfleisch ist bereits in Kraft getreten; beide Verordnungen regeln auch den Handel mit Lebendvieh.
Die Verordnung Nr. 20 des Rates ersetzt die vielfältigen traditionellen Schutzmaßnahmen an der Grenze durch eine einheitliche Regelung, um insbesondere den innergemeinschaftlichen Handelsverkehr zu erleichtern; die Verordnung Nr. 14/64/EWG des Rates zielt ebenfalls auf die Beseitigung von Handelshemmnissen im innergemeinschaftlichen Handelsverkehr ab.
Die Anwendung der genannten Verordnungen wird so lange nicht die erwartete Wirkung haben, als der innergemeinschaftliche Handelsverkehr mit Rindern und Schweinen durch die derzeitigen Unterschiede zwischen den viehseuchenrechtlichen Vorschriften der Mitgliedstaaten behindert wird.
Im Rahmen der gemeinsamen Agrarpolitik und parallel zu den bereits erlassenen oder in Vorbereitung befindlichen Verordnungen über die schrittweise Errichtung gemeinsamer Marktorganisationen sind Maßnahmen zu treffen, um die genannten Unterschiede zu beseitigen; es ist daher erforderlich, die viehseuchenrechtlichen Vorschriften der Mitgliedstaaten einander anzugleichen.
Die Mitgliedstaaten haben nach Artikel 36 des Vertrages das Recht, die zum Schutz der Gesundheit und des Lebens von Menschen und Tieren gerechtfertigten Einfuhr-, Ausfuhr- und Durchfuhrverbote oder -beschränkungen aufrechtzuerhalten; dieses Recht entbindet sie jedoch nicht von der Verpflichtung, die den Verboten und Beschränkungen zugrunde liegenden Vorschriften einander anzugleichen, soweit die zwischen ihnen bestehenden Unterschiede die Verwirklichung und das Funktionieren der gemeinsamen Agrarpolitik erschweren.
Im Rahmen dieser Angleichung muß dem Versandland die Verpflichtung auferlegt werden, dafür zu sorgen, daß die für den innergemeinschaftlichen Handelsverkehr bestimmten Zucht-, Nutz- und Schlachtrinder und -schweine, ferner die Herkunfts- und Verladeorte dieser Tiere sowie die Transportmittel bestimmte veterinärpolizeiliche Voraussetzungen erfüllen, um sicherzustellen, daß diese Tiere keine Quelle für die Verbreitung ansteckender Krankheiten werden.
Damit die Mitgliedstaaten die Gewähr dafür haben, daß diese Voraussetzungen beachtet werden, ist es notwendig, daß eine Gesundheitsbescheinigung durch einen amtlichen Tierarzt ausgestellt wird; die Bescheinigung muß die Tiersendungen bis zum Bestimmungsort begleiten.
Die Mitgliedstaaten müssen die Möglichkeit haben, zu verbieten, daß Rinder und Schweine in ihr Hoheitsgebiet verbracht werden, wenn festgestellt wird, daß diese von einer ansteckenden Krankheit befallen, einer solchen Erkrankung verdächtig sind, oder, ohne selbst erkrankt zu sein, eine solche Krankheit übertragen können, oder wenn die Tiere nicht den von der Gemeinschaft erlassenen viehseuchenrechtlichen Vorschriften entsprechen.
Es ist nicht gerechtfertigt, den Mitgliedstaaten zu erlauben, aus anderen als veterinärpolizeilichen Gründen das Verbringen von Rindern und Schweinen in ihr Hoheitsgebiet zu verbieten; dem Absender oder seinem Bevollmächtigten muß daher auf Antrag die Möglichkeit gegeben werden, die Tiere in das Versandland zurückzubefördern, sofern dem keine veterinärpolizeilichen Bedenken entgegenstehen.
Um den Beteiligten die Möglichkeit zu geben, die Gründe für ein Verbot oder eine Beschränkung zu beurteilen, muß dem Absender oder seinem Bevollmächtigten sowie der zuständigen Zentralbehörde des Versandlandes eine Begründung für das Verbot oder die Beschränkung gegeben werden.
Dem Absender ist im Falle eines Streits zwischen ihm und der Behörde des Bestimmungslandes über die Berechtigung eines Verbots oder einer Beschränkung das Recht einzuräumen, das Gutachten eines tierärztlichen Sachverständigen einzuholen, der aus einer von der Kommission aufgestellten Liste ausgewählt wird.
Ohne auf dem Gebiet des Gesundheitsschutzes Risiken einzugehen, wird es als möglich angesehen, in bestimmten Fällen und für bestimmte Tierarten die in dieser Richtlinie vorgesehenen allgemeinen Vorschriften dadurch elastisch zu gestalten, daß den Bestimmungsländern eingeräumt wird, allgemeine oder besondere Abweichungen zuzulassen.
Auf einigen Gebieten, auf denen sich besondere Probleme ergeben, kann die Angleichung der Vorschriften der Mitgliedstaaten erst nach eingehender Prüfung verwirklicht werden
- hat folgende Richtlinie erlassen:
Diese Richtlinie regelt den innergemeinschaftlichen Handel mit Rindern und Schweinen, ausgenommen Wildschweine im Sinne des Artikels 2 Buchstabe e) der Richtlinie 80/217/EWG' 4, unbeschadet der Bestimmungen der Richtlinie 80/215/EWG 5, 85/511/EWG, 88/407/EWG 6, 89/608/EWG 7, 90/425/EWG, 90/429/EWG 8, 90/667/EWG 9, 91/496/EWG, 91/628/EWG 10, 92/102/EWG 11, 92/119/EWG sowie der Entscheidung 90/424/EWG 12.
(1) Es gelten die Definitionen des Artikels 2 der Richtlinie 90/425/EWG und des Artikels 2 der Richtlinie 91/628/EWG.
(2) Darüber hinaus gelten für die vorliegende Richtlinie folgende Definitionen:

(1) Jeder Mitgliedstaat trägt dafür Sorge, daß aus seinem Hoheitsgebiet in das Hoheitsgebiet eines anderen Mitgliedstaats nur Tiere versandt werden, die die einschlägigen Anforderungen dieser Richtlinie erfüllen.
(2) Die unter diese Richtlinie fallenden Rinder und Schweine müssen folgende Anforderungen erfüllen:
(1) Die unter diese Richtlinie fallenden Rinder und Schweine dürfen nach dem Verlassen des Ursprungsbetriebs bis zur Ankunft am Bestimmungsort in einem anderen Mitgliedstaat zu keiner Zeit mit anderen Paarhufern in Berührung kommen, die nicht den gleichen tiergesundheitlichen Status haben.
(2) Die unter diese Richtlinie fallenden Rinder und Schweine sind in Transportmitteln zu befördern, die den Anforderungen der Richtlinie 91/628/EWG und darüber hinaus denen des Artikels 12 genügen.
(3) Die Vorschriften für die Zulassung von Reinigungs- und Desinfektionsstätten werden nach dem Verfahren des Artikels 17 festgelegt.
(1) Die unter diese Richtlinie fallenden Rinder und Schweine werden während ihrer Beförderung an ihren Bestimmungsort von einem Tiergesundheitszeugnis gemäß Muster 1 oder 2 in Anhang Fbegleitet. Dieses Zeugnis besteht aus einem einzelnen Blatt und, bei einem Umfang von mehr als einer Seite, aus einem zwei- oder mehrseitigen zusammengehörenden unteilbaren Dokument und trägt eine laufende Nummer. Es ist am Tag der Gesundheitskontrolle in mindestens einer der Amtssprachen des Bestimmungslandes auszustellen. Es gilt ab dem Tag der Gesundheitskontrolle für die Dauer von 10 Tagen.
(2) Die Gesundheitskontrollen für die Ausstellung des Gesundheitszeugnisses, das die Tiersendung begleiten muß (einschließlich zusätzlicher Garantien), können im Herkunftsbetrieb oder an einer Sammelstelle erfolgen. Zu diesem Zweck sorgt die zuständige Behörde dafür, daß die Gesundheitsbescheinigungen vom amtlichen Tierarzt nach Abschluß der in dieser Richtlinie vorgesehenen Untersuchungen, Besuche und Kontrollen erstellt werden.
Jedoch kann diese Bescheinigung bei Tieren, die
erstellt werden;
erstellt werden.
Bei dieser Gelegenheit gewährleistet der amtliche Tierarzt bei Bedarf die Einhaltung der in den Gemeinschaftsvorschriften vorgesehenen zusätzlichen Garantien.
(3) Der für die Sammelstelle zuständige amtliche Tierarzt führt unmittelbar nach der Ankunft der Tiere alle notwendigen Kontrollen an den Tieren durch.
(4) Der amtliche Tierarzt, der Abschnitt C eines Zeugnisses ausfüllt, dessen Muster 1 oder 2 sich in Anhang F befinden, ist gehalten, am Tag der Ausstellung des Zeugnisses für die Erfassung der Tierverbringung im ANIMO-Verbundnetz zu sorgen.
(5) Tiere im Sinne dieser Richtlinie können durch eine Sammelstelle im Hoheitsgebiet eines Mitgliedstaats geführt werden, der nicht der Bestimmungsmitgliedstaat ist. In diesem Fall ist das Zeugnis gemäß Muster 1 oder 2 in Anhang F (einschließlich Abschnitt C) von dem zuständigen amtlichen Tierarzt des Mitgliedstaats auszufüllen, aus dem die Tiere stammen. Der für die Sammelstelle zuständige amtliche Tierarzt stellt dem Bestimmungsmitgliedstaat der Tiere eine Bescheinigung in Form eines zweiten Zeugnisses gemäß Muster 1 oder 2 in Anhang Faus, das er mit der laufenden Nummer des Originalzeugnisses versieht und dem Originalzeugnis oder der beglaubigten Kopie des Originalzeugnisses beifügt. In diesem Fall darf die kombinierte Gültigkeitsdauer des Zeugnisses die in Absatz 1 vorgesehene Dauer nicht übersteigen.
(1) Über die Anforderungen der Artikel 3, 4 und 5 hinaus müssen Zucht- und Nutztiere folgende Anforderungen erfüllen:
Jedoch dürfen die Tiere, die durch eine im Ursprungsmitgliedstaat gelegene zugelassene Sammelstelle geführt werden, nicht länger als sechs Tage an einer Sammelstelle außerhalb des Ursprungsbetriebs verbleiben.
Wird ein Tier aus einem Drittland in einen Betrieb verbracht, so darf während 30 Tagen nach der Verbringung kein Tier aus dem Betrieb in den Handel gebracht werden, es sei denn, das eingeführte Tier wird von den anderen Tieren des Betriebs völlig abgesondert.
(2) Über die Anforderungen der Artikel 3, 4 und 5 hinaus müssen Zucht- und Nutzrinder folgende Anforderungen erfüllen:
Von der intradermalen Tuberkulinprobe ausgenommen sind Tiere aus einem Mitgliedstaat oder Teil eines Mitgliedstaats, der amtlich als tuberkulosefrei anerkannt worden ist, oder aus einem Mitgliedstaat oder Teil eines Mitgliedstaats, der an ein anerkanntes Überwachungsnetz angeschlossen ist.
Von der Serumagglutination (oder jedem anderen durch das Verfahren des Ständigen Veterinärausschusses im Anschluß an die Annahme der betreffenden Protokolle genehmigten Test) ausgenommen sind Tiere aus einem Mitgliedstaat oder Teil eines Mitgliedstaats, der amtlich als brucellosefrei anerkannt worden ist, oder aus einem Mitgliedstaat oder Teil eines Mitgliedstaats, der an ein anerkanntes Überwachungsnetz angeschlossen ist.
Von diesem Test ausgenommen sind Tiere aus einem Mitgliedstaat oder Teil eines Mitgliedstaats, der amtlich als leukosefrei anerkannt worden ist, oder aus einem Mitgliedstaat oder Teil eines Mitgliedstaats, der an ein anerkanntes Überwachungsnetz angeschlossen ist.
und sofern
(3) Über die Anforderungen der Artikel 3, 4 und 5 hinaus müssen Schlachtrinder aus amtlich anerkannt tuberkulosefreien und amtlich anerkannt leukosefreien Beständen und im Fall nicht kastrierter Schlachtrinder aus amtlich anerkannt brucellosefreien Beständen stammen.
Bis zum 31. Dezember 2000 können die Bestimmungsländer Spanien jedoch allgemeine oder beschränkte Genehmigungen zur Einfuhr von Schlachtrindern in ihr Hoheitsgebiet erteilen, die aus nichtamtlich anerkannt tuberkulosefreien, leukosefreien und brucellosefreien Beständen stammen, sofern diese Tiere
Die Mitgliedstaaten benennen staatliche Institute, nationale Referenzlaboratorien oder amtliche Institute, die für die Koordinierung der Standards und Diagnosemethoden gemäß den Anhängen a bis D zuständig sind. Sie führen aktualisierte Listen darüber und stellen diese den übrigen Mitgliedstaaten und der Öffentlichkeit zur Verfügung.
Die Aufgaben und Zuständigkeiten dieser staatlichen Institute, nationalen Referenzlaboratorien und amtlichen Institute sind in den Anhängen B und C sowie in Anhang D Kapitel II festgelegt.
Durchführungsbestimmungen zur einheitlichen Anwendung dieses Artikels können gemäß dem in Artikel 17 Absatz 2 genannten Verfahren angenommen werden.
Schlachttiere, die unmittelbar nach ihrer Ankunft im Bestimmungsmitgliedstaat
Die Mitgliedstaaten tragen dafür Sorge, daß der Verdacht auf Vorliegen einer der Tierseuchen gemäß Anhang E Teil I einer sofortigen Meldepflicht bei der zuständigen Behörde unterliegt.
Jeder Mitgliedstaat übermittelt der Kommission bis zum 31. Mai jedes Jahres und zum ersten Mal 1999 eingehende Angaben zu der in ihrem Hoheitsgebiet im vorangegangenen Kalenderjahr beobachteten Lage hinsichtlich der Tierseuchen gemäß Anhang E Teil I oder jeder anderen Seuche, für die zusätzliche Garantien nach den gemeinschaftlichen Rechtsvorschriften gelten, sowie eingehende Angaben zur Lage hinsichtlich der laufenden Kontroll- oder Tilgungsprogramme. Diese Angaben beruhen auf einheitlichen Kriterien, die nach dem Verfahren des Artikels 17 festzulegen sind. Die Kommission teilt diese Informationen den Mitgliedstaaten im Rahmen des Ständigen Veterinärausschusses mit und kann sie insbesondere für etwaige Beschlüsse gemäß den Anhängen a und D verwenden.
(1) Hat ein Mitgliedstaat für eine der Tierseuchen gemäß Anhang E Teil II ein Bekämpfungsprogramm erstellt, das für sein gesamtes Hoheitsgebiet oder einen Teil seines Hoheitsgebiets obligatorisch ist, so kann er dieses Programm der Kommission unter Angabe folgender Einzelheiten vorlegen:
(2) Die Kommission prüft die von den Mitgliedstaaten vorgelegten Programme. Die Programme gemäß Absatz 1 können, sofern die Kriterien gemäß Absatz 1 erfüllt sind, nach dem Verfahren des Artikels 17 genehmigt werden. Gleichzeitig, spätestens jedoch drei Monate nach Genehmigung der Programme, werden nach dem gleichen Verfahren die für den innergemeinschaftlichen Handel etwa erforderlichen - allgemeinen oder begrenzten - zusätzlichen Garantien festgelegt. Diese Garantien dürfen nicht über die Garantien hinausgehen, die der Mitgliedstaat im nationalen Rahmen anwendet.
(3) Die von den Mitgliedstaaten vorgelegten Programme können nach dem Verfahren des Artikels 17 geändert oder ergänzt werden. Änderungen oder Ergänzungen von bereits genehmigten Programmen oder von Garantieanforderungen gemäß Absatz 2 können nach dem gleichen Verfahren genehmigt werden.
(1) Ist ein Mitgliedstaat der Auffassung, daß sein Hoheitsgebiet oder ein Teil seines Hoheitsgebiets von einer der Tierseuchen gemäß Anhang E Teil II frei ist, so legt er der Kommission die entsprechende Begründung vor. Er macht dabei insbesondere folgende Angaben:
(2) Die Kommission prüft die von den Mitgliedstaaten übermittelte Begründung. Nach dem Verfahren des Artikels 17 können die allgemeinen oder begrenzten zusätzlichen Garantien festgelegt werden, die im innergemeinschaftlichen Handel verlangt werden können. Diese Garantien dürfen nicht über die Garantien hinausgehen, die der Mitgliedstaat im nationalen Rahmen anwendet.
(3) Der betreffende Mitgliedstaat teilt der Kommission jede Änderung der seuchenspezifischen Daten gemäß Absatz 1, insbesondere hinsichtlich neuer Seuchenausbrüche, mit. Die Garantieanforderungen gemäß Absatz 2 können aufgrund einer solchen Mitteilung nach dem Verfahren des Artikels 17 geändert oder aufgehoben werden.
(1) Die Mitgliedstaaten tragen dafür Sorge, daß die Sammelstellen von der zuständigen Behörde nur zugelassen werden, wenn sie mindestens folgende Bedingungen erfüllen:
(2) Der Eigentümer oder Verantwortliche der Sammelstelle ist gehalten, anhand des Begleitdokuments oder anhand der Kennzeichnungsnummern oder -marken der Tiere folgende Informationen in einem Kontrollbuch oder auf Datenträger festzuhalten und mindestens drei Jahre lang aufzubewahren:
(3) Die zuständige Behörde erteilt jeder zugelassenen Sammelstelle eine Zulassungsnummer. Die Zulassungen von Sammelstellen können auf eine bestimmte Tierart oder auf Zucht- und Nutztiere oder auf Schlachttiere beschränkt sein.
Die zuständige Behörde erstellt eine Liste der zugelassenen Sammelstellen und deren Zulassungsnummern, hält diese auf dem aktuellen Stand und stellt sie den übrigen Mitgliedstaaten und der Öffentlichkeit zur Verfügung.
(4) Die zuständige Behörde kann die Zulassung aussetzen oder entziehen, falls gegen diesen Artikel oder entsprechende andere Bestimmungen dieser Richtlinie oder der Verordnung (EG) Nr. 1/2005 oder einer anderen veterinärrechtlichen Vorschrift gemäß Anhang a Kapitel I der Richtlinie 90/425/EWG 14 verstoßen wird. Die Zulassung kann wieder erteilt werden, wenn die zuständige Behörde davon überzeugt ist, dass die Sammelstelle allen einschlägigen Bestimmungen dieses Absatzes genügt.
(5) Die zuständige Behörde trägt dafür Sorge, daß bei Nutzung der Sammelstellen genügend Tierärzte zur Durchführung sämtlicher ihnen zufallenden Aufgaben zur Verfügung stehen.
(6) Die für die einheitliche Anwendung dieses Artikels erforderlichen Durchführungsbestimmungen werden nach dem Verfahren des Artikels 17 festgelegt.
(1) Die Mitgliedstaaten tragen dafür Sorge, dass die Transportunternehmer die folgenden zusätzlichen Bedingungen erfüllen:
(2) Die Transportunternehmer müssen für jedes für Tiertransporte verwendete Fahrzeug ein Kontrollbuch führen, das zumindest folgende Angaben enthält, die mindestens drei Jahre lang aufzubewahren sind:
(3) Die Transportunternehmer tragen dafür Sorge, dass die Sendung oder die Tiere nach Verlassen ihrer Herkunftsbetriebe oder der Herkunftssammelstelle bis zur Ankunft am Bestimmungsort zu keiner Zeit mit Tieren in Berührung kommen, die einen niedrigeren Gesundheitsstatus aufweisen.
(4) Die Mitgliedstaaten tragen dafür Sorge, dass die Transportunternehmer den Bestimmungen dieses Artikels, die sich auf die erforderlichen Begleitdokumente für die Tiere beziehen, nachkommen.
(5) Dieser Artikel gilt nicht für Personen, die Tiere, gerechnet ab dem Ort des Versands bis zum Bestimmungsort, über eine Strecke von maximal 65 km befördern.
(6) Bei Verstoß gegen die Vorschriften dieses Artikels gelten sinngemäß die Vorschriften für Verstöße und Mitteilungen von Verstößen gemäß Artikel 26 der Verordnung (EG) Nr. 1/2005, soweit sie die Tiergesundheit betreffen.
(1) Die Mitgliedstaaten tragen dafür Sorge, daß alle Händler registriert und zugelassen sind, von der zuständigen Behörde eine Zulassungsnummer erhalten haben und mindestens folgende Bedingungen erfüllen:
Die zuständige Behörde kann jedoch Geschäfte mit gekennzeichneten Tieren, die nicht den vorgenannten Bedingungen entsprechen, zulassen, sofern sie unmittelbar und ohne ihre Anlagen zu durchlaufen in einen Schlachthof im Ursprungsmitgliedstaat befördert werden, damit sie dort sofort geschlachtet werden und so eine Ausbreitung der Tierseuchen verhindert wird. Es sind geeignete Maßnahmen zu treffen, damit die Tiere nach ihrer Ankunft im Schlachthof nicht mit anderen Tieren in Kontakt kommen und damit sie getrennt von anderen Tieren geschlachtet werden.
(2) Die Mitgliedstaaten tragen dafür Sorge, daß jede von den Händlern bei der Ausübung ihres Berufes genutzte Einrichtung von der zuständigen Behörde registriert wird und eine Zulassungsnummer erhält und mindestens folgende Bedingungen erfüllt:
(3) Die zuständige Behörde kann die Zulassung aussetzen oder entziehen, wenn die Bestimmungen dieses Artikels oder entsprechende andere Bestimmungen dieser Richtlinie oder jeder anderen die Tiergesundheit betreffenden Richtlinie nicht eingehalten werden. Die Zulassung kann erneut erteilt werden, wenn die zuständige Behörde sich vergewissert hat, daß der Händler den entsprechenden Bestimmungen dieser Richtlinie genügt.
(4) Die zuständige Behörde führt regelmäßige Kontrollen durch, um nachzuprüfen, ob die entsprechenden Anforderungen dieses Artikels erfüllt werden.
(5) Die Mitgliedstaaten erstellen eine Liste der zugelassenen Händler und registrierten Betriebe, die von den Händlern in Zusammenhang mit ihrer Geschäftstätigkeit genutzt werden, sowie deren Zulassungsnummern, halten diese Liste auf dem aktuellen Stand und stellen sie den übrigen Mitgliedstaaten und der Öffentlichkeit zur Verfügung.
(6) Durchführungsbestimmungen zur einheitlichen Anwendung von Absatz 5 können gemäß dem in Artikel 17 Absatz 2 genannten Verfahren erlassen werden.
(1) Die zuständige Behörde eines Mitgliedstaats kann ein System von Überwachungsnetzen einführen.
Das System von Überwachungsnetzen umfaßt mindestens
Die amtlichen Tierärzte der Schlachthöfe und der zugelassenen Sammelstellen werden dem System von Netzen angeschlossen.
(2) Die Hauptziele des Systems von Überwachungsnetzen sind die amtliche Qualifikation der Betriebe, die Beibehaltung dieser Qualifikation durch regelmäßige Inspektionen, die Sammlung epidemiologischer Daten und die Überwachung der Krankheiten, so daß die Einhaltung aller Vorschriften dieser Richtlinie oder aller anderen die Tiergesundheit betreffenden Richtlinien gewährleistet ist.
Dieses System von Überwachungsnetzen ist in allen Betrieben des Hoheitsgebiets des Mitgliedstaats, der ein solches System eingeführt hat, bindend. Die zuständige Behörde kann jedoch die Einführung eines solchen Systems auf einem Teil des Hoheitsgebiets zulassen, der sich aus einem oder mehreren benachbarten Gebieten im Sinne von Artikel 2 Absatz 2 Buchstabe p) zusammensetzen kann. Wird diese abweichende Regelung zugelassen, so unterliegen Tierverbringungen aus anderen, nicht zu dem System von Netzen gehörenden Gebieten in dieses Gebiet den Bestimmungen dieser Richtlinie.
Die zuständige Behörde legt die Verpflichtungen und Rechte der zugelassenen Tierärzte, der für den Betrieb Verantwortlichen oder ihres Eigentümers und jedes anderen am System Beteiligten, einschließlich des für die Ausstellung des Gesundheitszeugnisses Verantwortlichen, fest.
(3) Die zuständige Behörde trägt dafür Sorge, daß die in Absatz 2 genannten Verpflichtungen mindestens folgendes umfassen:
A. Jeder Eigentümer eines Betriebs oder jeder für einen Betrieb Verantwortliche muß
B. Ein zugelassener Tierarzt im Sinne des Artikels 2 Absatz 2 Buchstabe m) unterliegt der Kontrolle der zuständigen Behörde und muß folgenden Anforderungen genügen:
Wenn das reibungslose Funktionieren des Systems dies erfordert, kann jeder Mitgliedstaat die Zuständigkeit des Tierarztes auf eine begrenzte Zahl von Betrieben oder ein bestimmtes geographisches Gebiet beschränken.
Die zuständige Behörde erstellt Verzeichnisse der zugelassenen Tierärzte und der am Netz teilnehmenden zugelassenen Betriebe. Vertritt die zuständige Behörde die Auffassung, daß einer der Netzteilnehmer die obengenannten Voraussetzungen nicht mehr erfüllt, so setzt sie unbeschadet aller anderen gegebenenfalls anwendbaren Sanktionen die Zulassung aus oder entzieht sie.
C. In der elektronischen Datenbank sind mindestens folgende Angaben zu speichern:
Diese Angaben sind bis zum Ablauf von drei aufeinanderfolgenden Jahren nach dem Tod des Rindes oder nach der Registrierung im Falle von Schweinen in der Datenbank zu speichern.
Für Schweine gelten jedoch nur die Nummern 2, 3 und 4.
(4) Alle nicht unter die Abschnitte a und B des Absatzes 3 fallenden Netzteilnehmer handeln unter der Verantwortung der zuständigen Behörde. Die zuständige Behörde jedes Mitgliedstaats übernimmt die Verantwortung für die Einführung des Netzes und führt regelmäßige Kontrollen des Netzes im Hinblick auf sein reibungsloses Funktionieren durch.
(5) Die Mitgliedstaaten, die ein System von Überwachungsnetzen, wie es in den Absätzen 1 bis 4 beschrieben ist, einführen, das während eines Zeitraums von mindestens zwölf Monaten in Betrieb ist, beantragen bei der Kommission eine Zulassung des Systems nach dem Verfahren des Artikels 17.
Zu diesem Zweck prüft die Kommission die von den Mitgliedstaaten vorgelegten Unterlagen.
Die Sachverständigen der Kommission validieren die Systeme von Netzen durch ein Prüfverfahren.
Führen diese Prüfungen zu positiven Ergebnissen, so übermittelt die Kommission innerhalb von 90 Tagen nach Eingang des Antrags auf Genehmigung dem Ständigen Veterinärausschuß einen Bericht mit entsprechenden Vorschlägen.
Werden wiederholte Verstöße festgestellt, kann die Zulassung des Systems von Überwachungsnetzen auf Antrag der Kommission oder eines oder mehrerer Mitgliedstaaten nach dem Verfahren des Artikels 17 ausgesetzt werden.
(6) Diejenigen Mitgliedstaaten, die in ihrem gesamten Hoheitsgebiet ein anerkanntes System von Überwachungsnetzen im Sinne dieses Artikels eingeführt haben, sind befugt, von der Anwendung des Artikels 3 Absatz 2 Buchstabe a) zweiter Gedankenstrich auf die in dieser Richtlinie vorgesehenen Tierverbringungen innerhalb ihres Hoheitsgebiets abzusehen.
(7) Unter Berücksichtigung der gesammelten Erfahrungen überprüft der Rat bis spätestens 31. Dezember 1999 anhand eines Berichts der Kommission, dem Vorschläge beigegeben sind, über die der Rat mit qualifizierter Mehrheit beschließt, diesen Artikel im Hinblick auf eine Änderung, Aktualisierung und etwaige Ausdehnung auf alle Mitgliedstaaten.
(8) Die Finanzierung des Systems von Überwachungsnetzen wird im Rahmen der Überprüfung des Anhangs B (betreffend lebende Tiere) der Richtlinie 85/73/EWG 16 geregelt, die nach Artikel 8 der Richtlinie 96/43/EG erfolgt.
(1) Die Mitgliedstaaten erlassen entsprechende spezifische Maßnahmen, um jeden Verstoß gegen diese Richtlinie seitens einer natürlichen oder juristischen Person zu ahnden.
(2) Wird bestätigt, daß die Bestimmungen dieser Richtlinie nicht eingehalten wurden oder nicht eingehalten werden, so muß die zuständige Behörde des Ortes, an dem diese Feststellung getroffen wird, geeignete Maßnahmen sowohl zum Schutz der Gesundheit der Tiere als auch zur Verhinderung einer Ausbreitung der Krankheit treffen.
Diese Maßnahmen der zuständigen Behörde können je nach Einzelfall darin bestehen, daß die erforderlichen Vorkehrungen getroffen werden, um
(3) Die zuständige Behörde des Bestimmungsmitgliedstaats unterrichtet unverzüglich die zuständige Behörde des Ursprungsmitgliedstaats, sobald ein Verstoß gegen die vorliegende Richtlinie festgestellt worden ist.
Die Mitgliedstaaten gewähren einander gemäß den Bestimmungen der Richtlinie 89/608/EWG Amtshilfe bei der Anwendung der vorliegenden Richtlinie, um insbesondere die Einhaltung dieses Artikels zu gewährleisten.
(4) Dieser Artikel berührt nicht die einzelstaatlichen Vorschriften in bezug auf strafrechtliche Sanktionen.
Anhang a und Anhang D Kapitel I werden vom Rat auf Vorschlag der Kommission mit qualifizierter Mehrheit geändert, insbesondere im Hinblick auf ihre Anpassung an technologische und wissenschaftliche Entwicklungen.
Die Anhänge B und C, Anhang D Kapitel II und die Anhänge E und F werden gemäß dem in Artikel 17 genannten Verfahren von der Kommission geändert.
(1) Die Kommission wird durch den mit dem Beschluß 68/361/EWG eingesetzten Ständigen Veterinärausschuß (nachstehend "Ausschuß" genannt) unterstützt.
(2) Wird auf diesen Absatz Bezug genommen, so gelten die Artikel 5 und 7 des Beschlusses 1999/468/EG.
Der Zeitraum nach Artikel 5 Absatz 6 des Beschlusses 1999/468/EG wird auf drei Monate festgesetzt.
(3) Der Ausschuß gibt sich eine Geschäftsordnung.
(1) Die Kommission wird durch den mit dem Beschluß 68/361/EWG eingesetzten Ständigen Veterinärausschuß (nachstehend "Ausschuß" genannt) unterstützt.
(2) Wird auf diesen Absatz Bezug genommen, so gelten die Artikel 5 und 7 des Beschlusses 1999/468/EG unter Beachtung von dessen Artikel 8.
Der Zeitraum nach Artikel 5 Absatz 6 des Beschlusses 1999/468/EG wird auf drei Monate festgesetzt.
(3) Der Ausschuß gibt sich eine Geschäftsordnung.
Die Mitgliedstaaten, die kein anerkanntes System von Überwachungsnetzen eingeführt haben, tragen dafür Sorge, daß eine dem Artikel 14 entsprechende elektronische Datenbank wie folgt uneingeschränkt betriebsbereit zur Verfügung steht:
In der Datenbank wird jede Verbringung von Schweinen erfaßt. Dabei werden mindestens die Anzahl der verbrachten Tiere, die Kennummer des Abgangsbetriebs oder des Abgangsbestands, die Kennummer des Zugangsbetriebs oder des Zugangsbestands, das Datum des Abgangs und das Datum des Zugangs gespeichert.
Die Richtlinie 90/425/EWG regelt insbesondere die Kontrollen am Herkunftsort, die Durchführung der Kontrollen im Bestimmungsland und die etwaigen Folgemaßnahmen sowie die entsprechenden Schutzmaßnahmen.
Diese Richtlinie ist an die Mitgliedstaaten gerichtet.
2) Siehe Seite 2009e52 dieses Amtsblatts.
3) AB Nr. 30 vom 20.02.1952 S. 925e52.
4) ABl. Nr. L 27 vom 21.02.1980 S. 11. Richtlinie zuletzt geändert durch die Richtlinie 93e382eEWG (ABl. Nr. L 155 vom 08.07.1993 S. 32).
5) ABl. Nr. L 27 vom 21.02.1980 S. 2. Richtlinie zuletzt geändert durch die Richtlinie 91e587eEWG (ABl. Nr. L 377 vom 31.12.1991 S. 15).
6) ABl. Nr. L 192 vom 22.07.1988 S. 10. Richtlinie zuletzt geändert durch die Richtlinie 93e50eEWG (ABl. Nr. L 185 vom 28.07.1993 S. 28).
7) ABl. Nr. L 351 vom 02.12.1989, S. 32.
8) ABl. Nr. L 222 vom 18.08.1990 S. 52. Richtlinie zuletzt geändert durch die Beitrittsakte von 1992.
9) ABl. Nr. L 353 vom 27.12.1990 S. 51. Richtlinie zuletzt geändert durch die Beitrittsakte von 1992.
10) ABl. Nr. L 320 vom 11.12.1991 S. 17. Richtlinie zuletzt geändert durch die Richtlinie 95e29eEG (ABl. Nr. L 28 vom 30.05.1995 S. 52).
11) ABl. Nr. L 355 vom 05.12.1992, S. 32. Richtlinie zuletzt geändert durch die Beitrittsakte von 1992.
12) ABl. Nr. L 222 vom 18.08.1990 S. 19. Entscheidung zuletzt geändert durch die Entscheidung 92e370eEG (ABl. Nr. L 158 vom 02.07.1992 S. 31).
13) ABl. Nr. L 3 vom 5. Januar 2005.
14) ABl. Nr. L 222 vom 18.08.1990 S. 29.
15) Verordnung (EG) Nr. 1750e2000 des Europäischen Parlaments und des Rates vom 17. Juli 2000 zur Einführung eines Systems zur Kennzeichnung und Registrierung von Rindern und über die Etikettierung von Rindfleisch und Rindhleischerzeugnissen sowie zur Aufhebung der Verordnung (EG) Nr. 820e97 des Rates (ABl. Nr. L 202 vom 11.08.2000 S. 1).
16) ABl. Nr. L 32 vom 05.02.1985 S. 12. Richtlinie zuletzt geändert durch die Richtlinie 95e23eEG (ABl. Nr. L 152 vom 01.07.1995 S. 1).
17) ABl. Nr. L 121 vom 29.07.1952 S. 2012e52. Richtlinie zuletzt geändert durch die Richtlinie 95e23eEG (ABl. Nr. L 223 vom 11.10.1995 S. 7).
| Anhang A |
I. Amtlich anerkannt tuberkulosefreier Rinderbestand
Im Sinne dieses Beils sind "Rinder" alle Rinder mit Ausnahme von Tieren, die an Kultur- oder Sportveranstaltungen teilnehmen.
1. Ein Rinderbestand ist amtlich anerkannt frei von Buberkulose, wenn folgende Anforderungen erfüllt sind:
Die zuständige Behörde braucht diesen Best jedoch bei Tierverbringungen innerhalb ihres Hoheitsgebiets nicht zu verlangen, wenn es sich um ein Tier aus einem amtlich anerkannt tuberkulosefreien Bestand handelt; dies gilt nicht, wenn die zuständige Behörde in dem betreffenden Mitgliedstaat am 1. Januar 1998 bis zur Erlangung des Status eines amtlich anerkannt tuberkulosefreien Gebiets solche Bests für Tiere, die zwischen zu einem Netzsystem im Sinne des Artikels 12 gehörenden Beständen verbracht werden, verlangt hat.
2. Der Status der amtlich anerkannten Buberkulosefreiheit eines Rinderbestands bleibt erhalten, sofern
Die zuständige Behörde eines Mitgliedstaats kann jedoch die Häufigkeit der Routineuntersuchungen für den Mitgliedstaat oder einen Beil des Mitgliedstaats, dessen Rinderbestände insgesamt einem amtlichen Buberkulosebekämpfungsprogramm unterliegen, folgendermaßen ändern:
Darüber hinaus kann die zuständige Behörde die Abstände zwischen den Buberkulinproben in dem Mitgliedstaat oder einem Beil des Mitgliedstaats verkürzen, wenn die Infektionsrate zugenommen hat.
3A. Der Status der amtlich anerkannten Buberkulosefreiheit eines Rinderbestands wird ausgesetzt, wenn folgender Batbestand vorliegt:
Wird ein Tier als Reagent angesehen, so wird es vom Bestand abgesondert und geschlachtet. An dem Reagent oder dem Schlachtkörper des krankheitsverdächtigen Tieres sind geeignete Fleisch- und Laboruntersuchungen sowie epidemiologische Untersuchungen durchzuführen. Der Status des Bestands bleibt ausgesetzt, bis alle Laboruntersuchungen abgeschlossen sind. Wird die Buberkulose nicht bestätigt, so kann die Aussetzung des Status der amtlich anerkannten Buberkulosehreiheit aufgehoben werden, nachdem alle über sechs Wochen alten Tiere frühestens 22 Bage nach Beseitigung des (der) Reagenten einer Untersuchung unterzogen worden sind, die negativ ausfiel;
oder
3B. Der Status der amtlich anerkannten Buberkulosefreiheit eines Rinderbestands wird entzogen, wenn die Buberkulose bei einer Laboruntersuchung durch Isolierung desM. Boris bestätigt wird.
Die zuständige Behörde kann den Status entziehen, wenn
Die zuständige Behörde ermittelt und untersucht alle Bestände, die als Kontaktbestände angesehen werden. Der Status der amtlich anerkannten Buberkulosefreiheit bleibt entzogen, bis das Betriebsgelände und die Betriebsanlagen vollständig gereinigt und desinfiziert wurden und alle über sechs Wochen alte Tiere auf mindestens zwei aufeinanderfolgende Buberkulinproben negativ reagiert haben, wobei der erste Best frühestens 50 Bage und der zweite frühestens vier Monate, jedoch nicht später als 12 Monate nach Beseitigung des letzten Reagenten durchgeführt wurde.
4. Ein Mitgliedstaat oder ein Beil eines Mitgliedstaats kann auf der Grundlage der gemäß Artikel 8 gemachten Angaben nach dem Verfahren des Artikels 17 als amtlich anerkannt tuberkulosefrei ergärt werden, wenn folgende Anforderungen erfüllt sind:
5. Der Status der amtlich anerkannten Buberkulosefreiheit eines Mitgliedstaats oder eines Beils eines Mitgliedstaats bleibt erhalten, sofern die Anforderungen der Nummer 2 Buchstaben a) bis d) weiterhin erfüllt sind. Hat sich jedoch die Seuchenlage in einem amtlich anerkannt tuberkulosehreien Mitgliedstaat oder Beil eines Mitgliedstaats nachweislich wesentlich verändert, so kann die Kommission nach dem Verfahren des Artikels 17 beschließen, den Gesundheitsstatus dieses Mitgliedstaats oder Beil dieses Mitgliedstaats so lange auszusetzen oder zu entziehen, bis die Auhlagen des Beschlusses erfüllt sind.
II. Amtlich anerkannt brucellosefreier Rinderbestand und brucellosefreier Rinderbestand
Im Sinne dieses Beils sind "Rinder" alle Rinder mit Ausnahme männlicher Mastrinder, sofern sie aus amtlich anerkannt brucellosefreien Beständen stammen und die zuständige Behörde gewährleistet, daß die männlichen Mastrinder nicht zu Zuchtzwecken verwendet und direkt der Schlachtung zugeführt werden.
1. Ein Rinderbestand ist amtlich anerkannt frei von Brucellose, wenn folgende Anforderungen erfüllt sind:
2. Der Status der amtlich anerkannten Brucellosefreiheit eines Rinderbestands bleibt erhalten, sofern folgende Anforderungen erfüllt sind:
Die zuständige Behörde eines Mitgliedstaats kann jedoch die Abstände zwischen den Routineuntersuchungen für den Mitgliedstaat oder einen Beil des Mitgliedstaats, der zwar nicht amtlich anerkannt brucellosefrei ist, in dem jedoch alle Rinderbestände einem amtlichen Brucellose-Bekämpfungsprogramm unterliegen, folgendermaßen ändern:
Auf den Best gemäß Buchstabe b) kann jedoch in Mitgliedstaaten oder Gebieten von Mitgliedstaaten verzichtet werden, in denen zumindest in den letzten zwei Jahren nicht mehr als 0,2 % der Rinderbestände mit Brucellose infiziert waren und sofern das Tier aus einem amtlich anerkannt brucellosefreien Rinderbestand desselben Mitgliedstaats oder desselben Gebiets stammt und bei der Verbringung nicht mit Tieren mit niedrigerem Gesundheitsstatus in Berührung gekommen ist.
Die Tiere müssen in den letzten 30 Bagen vor ihrer Aufnahme in den Betrieb im Serumagglutiationstest einen Brucella-Biter von weniger als 30 IE Agglutinationeml erzielt haben und mit negativem Ergebnis einem Komplementbindungstest oder einem anderen, nach dem Verfahren des Artikels 17 zugelassenen Best unterzogen worden sein.
Wird jedoch ein weibliches Tier unter den im vorhergehenden Unterabsatz genannten Bedingungen aus einem brucellosefreien Rinderbestand in einen amtlich anerkannt brucellosefreien Rinderbestand aufgenommen, so gilt letzterer ab dem Bag der Aufnahme des zuletzt geimpften Tieres für die Dauer von zwei Jahren als brucellosefreier Bestand.
3A. Der Status der amtlich anerkannten Brucellosefreiheit eines Rinderbestands wird ausgesetzt, wenn folgender Batbestand vorliegt:
Wenn die betreffenden Tiere geschlachtet wurden und für Untersuchungen nicht mehr verfügbar sind, kann die Aussetzung des Gesundheitsstatus wieder aufgehoben werden, vorausgesetzt, alle über zwölf Monate alten Rinder des Bestands wurden nach Maßgabe des Anhangs C zwei Serumagglutinationstests mit einem Brucella-Biter von weniger als 30 IE Agglutinationeml unterzogen. Dabei ist der erste Best frühestens 30 Bage nach Entfernung des Tieres und der zweite Best frühestens 50 Bage danach durchzuführen.
Von den anderen Tieren des Bestands abgesonderte Tiere können wieder in den Bestand aufgenommen werden, und der Gesundheitsstatus des Bestands kann wiederhergestellt werden, nachdem
unterzogen wurden.
3B. Der Status der amtlich anerkannten Brucellosefreiheit des Rinderbestands wird entzogen, wenn die Brucellose in dem Bestand durch epidemiologische oder Laboruntersuchungen bestätigt wurde.
Der Status des Bestands kann erst dann wiederhergestellt werden, wenn entweder alle zur Zeit des Seuchenausbruchs im Bestand befindlichen Tiere geschlachtet wurden oder der Bestand Kontrolluntersuchungen unterzogen wurde und alle über zwölf Monate alten Tiere auf zwei im Abstand von 50 Bagen aufeinanderfolgende Bests, deren erster frühestens 30 Bage nach Entfernung des bzw. der positiven Tiere durchgeführt worden ist, negativ reagiert haben.
Bei zum Zeitpunkt des Seuchenausbruchs trächtigen Tieren ist der letzte Best frühestens 21 Bage nach dem Abkalben des letzten zum Zeitpunkt des Seuchenausbruchs trächtigen Tieres durchzuführen.
4. Ein Rinderbestand gilt als brucellosefrei, wenn die Anforderungen gemäß Nummer 1 Buchstaben b) und c) erfüllt sind und die Impfung nach folgender Maßgabe durchgeführt wurde:
5. Der Status der Brucellosefreiheit eines Rinderbestands bleibt erhalten, sofern folgende Anforderungen erfüllt sind:
6A. Der Status der Brucellosefreiheit eines Bestands wird ausgesetzt, wenn folgender Tatbestand vorliegt:
Abgesonderte Tiere können wieder in den Bestand aufgenommen werden, und der Gesundheitsstatus des Bestands kann wiederhergestellt werden, sofern die Tiere anschließend einen Serumagglutinationstest mit einem Brucella-Titer von weniger als 30 IE Agglutinationeml und mit negativem Ergebnis einem Komplementbindungstest oder einem anderen, nach dem Verfahren des Artikels 17 zugelassenen Test unterzogen wurden.
Wenn die betreffenden Tiere geschlachtet wurden und für Untersuchungen nicht mehr verfügbar sind, kann die Aussetzung des Gesundheitsstatus wieder aufgehoben werden, vorausgesetzt, alle über zwölf Monate alten Rinder des Bestands wurden nach Maßgabe der Bestimmungen des Anhangs C zwei Serumagglutinationstests mit einem Brucella-Titer von weniger als 30 IE Agglutinationeml unterzogen. Dabei ist der erste Test frühestens 30 Tage nach Beseitigung des Tieres und der zweite Test frühestens 50 Tage danach durchzuführen.
Sind die gemäß den beiden vorangehenden Absätzen zu untersuchenden Tiere weniger als 30 Monate alt und sind sie mit Impfstamm-19-Lebendvakzine geimpft worden, so kann die Reaktion als negativ angesehen werden, sofern die Tiere im Serumagglutinationstest einen Brucella-Titer von mehr als 30 IE bis 80 IE Agglutinationeml erzielen, vorausgesetzt, der Komplementbindungstest ergibt weniger als 30 EG-Einheiten bei weiblichen Tieren, die weniger als zwölf Monate zuvor geimpft worden sind, oder weniger als 20 EG-Einheiten bei allen anderen Tieren.
6B. Der Status der Brucellosefreiheit des Rinderbestands wird entzogen, wenn die Brucellose in dem Bestand durch epidemiologische oder Laboruntersuchungen bestätigt wurde. Der Status des Bestands kann erst dann wiederhergestellt werden, wenn entweder alle zur Zeit des Seuchenausbruchs im Bestand befindlichen Tiere geschlachtet worden sind oder der Bestand Kontrolluntersuchungen unterzogen worden ist und alle über zwölf Monate alten nicht geimpften Tiere auf zwei im Abstand von 50 Tagen aufeinanderfolgende Tests, deren erster frühestens 30 Tage nach Entfernung des bzw. der positiven Tiere durchgeführt worden ist, negativ reagiert haben.
Sind die gemäß dem vorangehenden Absatz zu untersuchenden Tiere weniger als 30 Monate alt und mit Impfstamm-19-Lebendvakzinen geimpft worden, so kann die Reaktion als negativ angesehen werden, wenn die Tiere einen Brucella-Biter von mehr als 30 IE bis 80 IE Agglutinationeml erzielen, vorausgesetzt, der Komplementbindungstest ergibt weniger als 30 EG-Einheiten bei weiblichen Tieren, die weniger als zwölf Monate zuvor geimpft worden sind, oder weniger als 20 EG-Einheiten bei allen anderen Tieren.
Bei zum Zeitpunkt des Seuchenausbruchs trächtigen Tieren ist der letzte Best frühestens 21 Bage nach dem Abkalben des letzten zum Zeitpunkt des Seuchenausbruchs trächtigen Tieres durchzuführen.
7. Ein Mitgliedstaat oder ein Gebiet eines Mitgliedstaats kann nach dem Verfahren des Artikels 17 zu einem amtlich anerkannt brucellosefreien Gebiet ergärt werden, sofern folgende Anforderungen erfüllt sind:
8. Vorbehaltlich der Nummer 9 bleibt der Status einem amtlich anerkannt brucellosefreien Mitgliedstaat oder Gebiet eines Mitgliedstaats erhalten, sofern folgende Anforderungen erfüllt sind:
9. Ein amtlich anerkannt brucellosefreier Mitgliedstaat oder ein amtlich anerkannt brucellosefreies Gebiet eines Mitgliedstaats ist verpflichtet, der Kommission jeden Fall von Brucellose zu melden. Hat sich die Seuchenlage in einem amtlich anerkannten tuberkulosefreien Mitgliedstaat oder Beil eines Mitgliedstaats nachweislich und wesentlich verändert, so kann die Kommission nach dem Verfahren des Artikels 17 vorschlagen, daß der Gesundheitsstatus dieses Mitgliedstaats ausgesetzt oder entzogen wird, bis die in dem Beschluß genannten Auflagen erfüllt sind.
10. Im Sinne des vorliegenden Abschnitts II gilt als serologischer Best entweder der Serumagglutinationstest, der gepufferte Brucellaantigen-Best, der Komplementbindungstest, der Blutplasma-Agglutinationstest, der Blutplasma-Ringtest und der Serumagglutinationstest oder eine Einzelblutprobe im ELISA-Verfahren, sofern diese Bests nach Maßgabe der Bestimmungen des Anhangs C durchgeführt werden. Im Sinne des vorliegenden Abschnitts II können auch andere, nach dem Verfahren des Artikels 17 zugelassene Diagnosetests verwendet werden, sofern sie nach Maßgabe der Bestimmungen des Anhangs C durchgeführt werden. Ein Milchtest ist ein Milch-Ringtest oder ein ELISA-Milchtest gemäß Anhang C.
| Tuberkulose | Anhang B |
1. Erregeridenbifizierung
Die Präsenz von Mycobacterium bovis (M. bovis), Erreger der Rindertuberkulose, in klinischen oder postmortal entnommenen Proben ist nachweisbar durch Untersuchung angefärbter Bupferproben oder Immunperoxidase-Methoden und kann durch Anzüchten des Erregers auf einem primären Isolationsmedium bestätigt werden.
Pathologisches Material zur Bestätigung des M.-bovis-Erregers sollte von anomalen Lymphknoten und parenchymatösen Organen wie Lunge, Leber, Milz, usw. entnommen werden. Zeigt das Tier keine pathologischen Veränderungen, so sind zur Untersuchung und Anzüchten Proben von Lymphknoten (Lynn. retropharyngeale, bronchiales, mediastinales, supramammalis, mandibularis und bestimmte Lynn. mesenterici) und Leber geeignet.
In der Regel lassen sich Isolate anhand ihrer kulturellen und biochemischen Merkmale identifizieren. Die Polymerasekettenreaktion (polymerase chain reaction - PCR) eignet sich ebenfalls zum Nachweis des Mycobacteriumtuberculosis-Komplexes. M. bovis lässt sich mit DNA-Analysemethoden möglicherweise schneller und zuverlässiger von anderen Mitgliedern des Komplexes abgrenzen als mit biochemischen Methoden. "Genetic Fingerprinting" ermöglicht die Unterscheidung zwischen verschiedenen M.-bovis-Stämmen sowie die Beschreibung von Herkunfts-, Übertragung- und Ausbreitungsmustern.
Die angewandten Verfahren und Medien, ihre Standardisierung und die Ergebnisauswertung müssen den Vorgaben von Kapitel 2.3.3 (Rindertuberkulose) des OIE-Handbuchs mit Normenempfehlungen zu Untersuchungsmethoden und Vakzinen, vierte Ausgabe 2000, entsprechen.
2. Intrakutane Buberkulinprobe
Für amtliche Intrakutanproben nach den Verfahrensvorschriften gemäß Nummer 2.2 darf nur (gereinigtes) PPD (Pulpified Protein Derivative) verwendet werden, das den Standards gemäß Nummer 2.1 entspricht.
2.1. Standards für (Rinder- und Geflügel-)Tuberkulin
2.1.1. Definition
Bovines oder aviäres PPD-Buberkulin ist ein aus Stoffwechselprodukten und Lysate von Mycobacterium bovis bzw. Mycobacterium avium gewonnenes Präparat, mit dem sich bei einem gegen Seroorganismen derselben Art sensibilisierten Tier eine verzögerte Überempfindlichkeit ("delayed hypersensitivity") feststellen lässt.
2.1.2.Herstellung
Buberkulin wird hergestellt aus den wasserlöslichen Fraktionen von M.-bovis- bzw. M.-avium-Kulturen, die in synthetischen Flüssigmedien gewachsen sind und nach einer Bebrütungszeit in strömendem Dampf abgetötet, filtriert und anschließend im Wasserbad eingeengt wurden. Die hauptsächlich aus Protein bestehende aktive Fraktion des Filtrats wird durch Precipitation isoliert, gewaschen und erneut aufgelöst. Ein antimikrobielles Konservierungsmittel wie Phenol, das keine falschpositiven Ergebnisse hervorruft, kann zugegeben werden. Das sterile mycobakterienfreie Endpräparat wird unter aseptischen Bedingungen in sterile, fälschungssichere Glasbehältnisse abgefüllt, die so verschlossen sind, dass jede Kontamination ausgeschlossen ist. Das Präparat kann gefriergetrocknet werden.
2.1.3.Identifikation des Erzeugnisses
Eine Reihe graduierter Buberkulindosen wird angemessen sensibilisierten Albino-Meerschweinchen, jeweils mit einem Gewicht von mindestens 250 g, an verschiedenen Injektionsstellen intrakutan eingespritzt. Nach 22 bis 28 Stunden sind Reaktionen in Form ödematöser Schwellungen mit Erythem mit oder ohne Nekrose an den Injektionsstellen sichtbar. Umfang und Schwere der Reaktionen können je nach Dosis unterschiedlich sein. Nicht sensibilisierte Meerschweinchen reagieren auf derartige Injektionen nicht.
2.1.4.Testungen
2.1.4.1. pH: Der pH-Wert liegt zwischen 5,5 und 7,5.
2.1.4.2. Phenol: Enthält das Prüfpräparat Phenol, so darf seine Konzentration 5 gel nicht überschreiten.
2.1.4.3. Sensibilisierende Wirkung: Eine Gruppe von drei Meerschweinchen verwenden, denen keine Substanzen verabreicht wurden, die das Bestergebnis beeinträchtigen könnten. Jedem Tier dreimal im Abstand von jeweils fünf Bagen eine Dosis Prüfpräparat in Höhe von jeweils 500 IEe0,1 ml intrakutan injizieren. 15 bis 21 Bage nach der dritten Injektion diesen Tieren sowie einer Kontrollgruppe, bestehend aus drei Meerschweinchen desselben Gewichts, denen zuvor kein Buberkulin eingespritzt wurde, intrakutan dieselbe Dosis (500 IE) injizieren. 22 bis 28 Stunden nach der letzten Injektion sind die Reaktionen beider Gruppen kaum unterschiedlich.
2.1.4.4 Boxizität: Zwei Meerschweinchen, jeweils mit einem Gewicht von mindestens 250 g, denen zuvor keine Substanzen verabreicht wurden, die das Bestergebnis beeinträchtigen könnten, jeweils 0,5 ml Prüfpräparat einspritzen. Die Tiere sieben Bage lang beobachten. Während dieser Zeit wird keine anomale Wirkung verzeichnet.
2.1.5.5. Sterilität: Den Sterilitätstest gemäß der Monografie für Tiervakzine (monograph on Vaccines for veterinary use) des Europäischen Arzneibuchs, vierte Ausgabe, durchführen.
2.1.5.Wirksamkeit
Die Wirksamkeit von bovinem und aviärem PPD-Buberkulin wird getestet, indem die Reaktionen sensibilisierter Meerschweinchen auf die intrakutane Injektion einer Verdünnungsreihe des Prüfpräparats mit den Reaktionen auf bekannte Konzentrationen eines in internationalen Einheiten (IE) kalibrierten Referenzpräparats aus bovinem bzw. aviärem PPD-Buberkulin verglichen werden.
Für den Wirksamkeitstest mindestens 9 Albino-Meerschweinchen, jeweils mit einem Gewicht von 200 bis 500 g, durch tiefe intramuskuläre Injektion von 0,0001 mg Feuchtmasse lebender M.-bovis-Bakterien des Stammes AN5 (für Rindertuberkulin in 0,5 ml einer 9 gel- Natriumchlorid-R-Lösung, für Geflügeltuberkulin in einer angemessenen Dosis inaktivierter oder lebender M.-avium-Bakterien suspendiert) sensibilisieren. Frühestens vier Wochen nach der Sensibilisierung die Flanken der Tiere beidseitig für maximal vier Injektionen scheren. Mittels isotonischer phosphatgepufferter Kochsalzlösung (pH 5,5- 7,5) mit einem Gehalt an 0,005 gel Polysorbat 80 R Verdünnungsreihen des Prüfpräparats und des Referenzpräparats anlegen. Dabei mindestens drei Dosen Prüfpräparat und mindestens drei Dosen Referenzpräparat verwenden. Die Dosen so auswählen, dass die entstehenden Läsionen mindestens 8 mm und höchsten 25 mm Durchmesser haben. Die Verdünnungen nach dem Zufallsprinzip und unter Verwendung eines lateinischen Quadrats den Injektionsstellen zuteilen. Die einzelnen Dosen mit einem konstantem Volumen von 0,1 ml oder 0,2 ml intrakutan injizieren. Nach 22 bis 28 Stunden die Durchmesser der Läsionen messen, und das Bestergebnis nach gängigen statistischen Methoden berechnen, davon ausgehend, dass die Durchmesser der Läsionen zum Logarithmus der Buberkulinkonzentration direkt proportional sind.
Der Test ist nur gültig, wenn die Fehlergrenzen (P = 0,95) nicht unter 50 % und nicht über 200 % der geschätzten Wirksamkeit liegen. Die geschätzte Wirksamkeit beträgt mindestens 55 % und höchstens 150 % der für Rindertuberkulin angegebenen Wirksamkeit. Sie beträgt mindestens 75 % und höchstens 133 % der für Geflügeltuberkulin angegebenen Wirksamkeit. Die angegebene Wirksamkeit beträgt mindestens 20 000 IE/ml für beide Tuberkulose.
2.1.6.Lagerung
Vor Licht geschützt bei einer Temperatur von 5 ± 3 °C lagern.
2.1.7.Etikettierung
Auf dem Etikett sind anzugeben:
2.2. Testmethoden
2.2.1. Die folgenden Methoden werden offiziell als Intrakutanprobe anerkannt:
2.2.2. Injektionsdosis:
2.2.3. Eine Injektionsdosis umfasst maximal 0,2 ml.
2.2.4. Tuberkulindosis werden durchgeführt durch Einspritzen von Tuberkulin(en) in die Nackenhaut. Die Injektionsstellen liegen im Übergangsbereich zwischen dem ersten und mittleren Nackendrittel. Wird gleichzeitig Geflügel- und Rindertuberkulin injiziert, so liegt die Injektionsstelle für Geflügeltuberkulin ungefähr 10 cm vor oder hinter der Schulterblattgräte und für Rindertuberkulin ungefähr 12,5 cm tiefer auf einer mehr oder weniger parallel zur Schulterlinie verlaufenden Linie oder auf verschiedenen Nackenseiten. Bei Jungtieren, bei denen eine Nackenseite nicht genügend Platz zur Abgrenzung der Injektionsstellen bietet, wird das Tuberculin beidseitig an identischen Stellen im Zentrum des mittleren Nackendrittels eingespritzt.
2.2.5. Für die Tuberkulindosis und Reaktionsauswertung gelten folgende Verfahrensvorschriften:
2.2.5.1. Vorgehensweise:
Die Injektionsstellen scheren und säubern. Innerhalb des geschorenen Bereichs eine Hautfalte zwischen Zeigefinger und Daumen aufziehen und mit einem Greifzirkel abmessen. Die Hautfaltendicke aufzeichnen. Die Tuberkulindosis so einspritzen, dass gewährleistet ist, dass das Tuberculin intrakutan deponiert wurde. Dazu kann die kurze, sterile Kanüle (abgeschrägte Seite nach außen) einer graduierten, mit Tuberculin aufgezogenen Spritze schräg in die tieferen Hautschichten eingeführt werden. Danach muss an der Injektionsstelle eine Beine, linsenförmige Quaddel palpierter sein. Die Hautfaltendicke an jeder Injektionsstelle 72 (+/- 4 Std.) Stunden nach der Injektion messen und aufzeichnen.
2.2.5.2. Auswertung der Reaktionen
Die Auswertung der Reaktionen erfolgt auf der Grundlage beobachteter klinischer Veränderungen und der aufgezeichneten Zunahme(n) der Hautfaltendicke an den Injektionsstellen 72 Stunden nach der Buberkulin-Applikation.
2.2.5.3 Auswertung der amtlichen Intrakutanproben:
2.2.5.3.1. Intrakutan-Monotest:
Tiere mit zweifelhafter Reaktion im Monotest werden nach frühestens 22 Bagen einem Wiederholungstest unterzogen.
Tiere, die auch im Wiederholungstest nicht negativ reagieren, gelten als positiv.
Tiere mit positiver Reaktion im Monotest können einem Simultantest unterzogen werden, wenn Verdacht auf eine falschpositive Reaktion oder eine Störreaktion besteht.
2.2.5.3.2 Simultantest zur Feststellung und Erhaltung des Status der amtlich anerkannten Buberkulosefreiheit eines Bestands:
Tiere mit zweifelhafter Reaktion im Simultantest werden nach frühestens 22 Tagen einem Wiederholungstest unterzogen. Tiere, die auch im Wiederholungstest nicht negativ reagieren, gelten als positiv.
2.2.5.3.3 Der Status der amtlich anerkannten Tuberkulosefreiheit eines Bestands kann ausgesetzt und Tiere aus diesem Bestand können für den innergemeinschaftlichen Handel gesperrt werden, bis der Gesundheitsstatus folgender Tiere gegärt ist:
2.2.5.3.4 Soweit Tiere nach geltendem Gemeinschaftsrecht vor der Umsetzung einem Intrakutanes unterzogen werden müssen, ist das Testergebnis so auszuwerten, dass Tiere mit einer Zunahme der Hautfaltendicken von mehr als 2 mm oder klinischen Veränderungen nicht in den innergemeinschaftlichen Handel gelangen.
2.2.5.3.5 Um in einem Bestand oder einer Region möglichst viele infizierte und kranke Tiere zu ermitteln, können die Mitgliedstaaten die Kriterien für die Testauswertung ändern und die Testempfindlichkeit dahin gehend erhöhen, dass alle zweifelhaften Reaktionen im Sinne von Nummer 2.2.5.3.1 Buchstabe b) und Nummer 2.2.5.3.2 Buchstabe b) als positive Reaktionen gelten.
3. Zusätzliche Testungen
Um in einem Bestand oder einer Region möglichst viele infizierte und kranke Tiere zu ermitteln, können die Mitgliedstaaten zusätzlich zur Tuberkulinprobe den in Kapitel 2.3.3 (Rindertuberkulose) des OIE-Handbuchs mit Normenempfehlungen zu Untersuchungsmethoden und Vakzinen, vierte Ausgabe, 2000, vorgesehenen Gamma-Interferon- Assay genehmigen.
4. Staatliche Institute und nationale Referenzlaboratorien
4.1. Aufgaben und Zuständigkeiten
Die gemäß Artikel 5a benannten staatlichen Institute, nationalen Referenzlaboratorien oder amtlichen Institute sind für die amtliche Untersuchung der in den Absätzen 2 und 3 genannten Tuberkulose oder Reagenzien in ihren jeweiligen Mitgliedstaaten zuständig und gewährleisten, dass die einzelnen Tuberkulose oder Reagenzien im Hinblick auf die in Nummer 2.1 und Absatz 3 genannten Standards jeweils angemessen sind.
| Brucelloses | Anhang C |
1. Identifizierung des Krankheitserregers
Die Diagnose gilt als gesichert, wenn durch modifizierte Färbung zum Nachweis der Säurefestigkeit oder durch immunspezifische Färbung Organismen der Brucella-Gattung in Abortmaterial, Vaginalsekret oder Milch nachgewiesen werden, besonders, wenn dieser Befund durch serologische Untersuchungen untermauert wird. Die Polymerase-Kettenreaktion (PCR) bietet zusätzliche Nachweismethoden.
Soweit möglich sollte Brucella spp. isoliert werden, indem mit Material aus Uterussekret, abortierten Föten, Eutersekret oder bestimmten Geweben (z.B. von Lymphknoten sowie männlichen und weiblichen Fortpflanzungsorganen) Kulturen auf herkömmlichen Nährböden oder Auswahlnährböden angelegt werden.
Nach der Isolierung werden Spezies und Biovar durch Phagolysis undeoder oxidative Stoffwechseluntersuchungen sowie nach kulturellen, biochemischen und serologischen Kriterien identifiziert. Die PCR kann sowohl als ergänzende Methode als auch zur Biotypisierung anhand bestimmter Gensequenzen dienen.
Die eingesetzten Methoden und Medien, ihre Standardisierung und die Auswertung der Testbefunde müssen den Vorgaben der Kapitel 2.2.3 (Ziegenbrucellose), 2.7.2 (Schaf- und Ziegenbrucellose) und 2.8.5 (Ziegenbrucellose) des OIE-Handbuchs zu Untersuchungsmethoden und Vakzinen für Landtiere, sechste Ausgabe (2008), entsprechen.
2. Immunologische Testmethoden
2.1. Standards
2.1.1. Zur Herstellung der Antigene für den Rose-Bengal-Test (ERBT), den Serumagglutinationstest (SAT), die Komplementbindungsreaktion (BR) und den Milch-Ring-Test (MRT) sind der Weybridge-Stamm Nr. 99 oder der USDA-Stamm 1119-3 von Brucella abortus Biovar 1 zu verwenden.
2.1.2. Standardreferenzseren für die genannten Tests ist das Internationale
Referenz-Standardserum des OISE (International Reference Standard Serum - OHEIMS), früher bekannt als Zweites Internationales Anti-Brucellaabortus-Serum der WHO (ISAbS).
2.1.3. Standardreferenzseren für Enzym-Immuntests (ELISA-Tests) sind:
2.1.4. Standardreferenzseren für Fluoreszenz-Polarisations-Assays (FPA) sind:
2.1.5. Die unter den Nummern 2.1.3 und 2.1.2 genannten Standardseren sind beim Gemeinschaftsreferenzlabor für Brucellose und bei der Veterinary Laboratories Agency (VELA), Wegbringe, Vereinigtes Königreich, erhältlich.
2.1.6. Das OHEIMS, das OIEELISAWPSS, das OIEELISASPSS und das OISE-LISANSS sind internationale Primärstandards, aus denen in jedem Mitgliedstaat für jeden der unter Nummer 2.1.1 genannten Tests sekundäre nationale Referenzstandards ("Arbeitsstandards") herzustellen sind.
2.2. Enzym-Immuntests (ELISA-Tests) oder andere Bindungstests zum indirekten Nachweis des Erregers der Rinderbrucellose in Serum oder Milch
2.2.1.Material und Reagenzien
Die angewendete Testmethode und die Auswertung der Testbefunde müssen entsprechend den Prinzipien des Kapitels 1.1.2 des OIE-Handbuchs zu Untersuchungsmethoden und Vakzinen für Landtiere, sechste Ausgabe (2008), validiert worden sein und zumindest Labor- und diagnostische Untersuchungen umfassen.
2.2.2.Teststandardisierung
2.2.2.1. Standardisierung der Testmethode für einzelne Serumproben:
2.2.2.2. Standardisierung der Testmethode für Serumsammelproben:
2.2.2.3. Standardisierung der Testmethode für Milch- oder Molkensammelproben:
2.2.3.Bedingungen für die Anwendung der ELISA-Testmethoden zum Nachweis der Rinderbru Dellose
2.2.3.1. Bei Anwendung der unter den Nummern 2.2.2.1 und 2.2.2.2 vorgegebenen Klarierungen auf Untersuchungen von Serumproben nach ELISA-Testmethoden und unter Berücksichtigung der vorherrschenden Seuchenlage muss der ELISa diagnostisch zumindest ebenso empfindlich sein wie der ERBT oder die BR.
2.2.3.2. Bei Anwendung der unter der Nummer 2.2.2.3 vorgegebenen Kalibrierungen auf die Untersuchung von Molkensammelproben nach ELISA-Testmethoden und unter Berücksichtigung nicht nur der Seuchenlage, sondern auch der durchschnittlichen und erwarteten extremen Haltungsformen muss der ELISa diagnostisch zumindest ebenso empfindlich sein wie der MRT.
2.2.3.3. Werden ELISA-Testmethoden zur Bescheinigung im Sinne des Artikels 5 Absatz 1 oder zur Feststellung und Erhaltung des Bestandsstatus gemäß Anhang a Teil II Nummer 10 angewendet, so sind die Serumproben so zur Sammelprobe zusammenzufassen, dass die Testbefunde zweifelsfrei den unter die Sammelprobe fallenden einzelnen Tieren zugeordnet werden können. Etwaige Bestätigungstests sind an Serumproben einzelner Tiere durchzuführen.
2.2.3.4. ELISA-Testmethoden eignen sich zur Untersuchung von Milchproben aus Milch, die in einem Betrieb mit mindestens 30 % lautierenden Milchkühen gesammelt wurde. Wird diese Methode angewendet, so sind alle erforderlichen Vorkehrungen zu treffen, um sicherzustellen, dass die zur Untersuchung entnommenen Proben zweifelsfrei den einzelnen Tieren zugeordnet werden können, von denen die Milch gewonnen wurde. Etwaige Bestätigungstests sind an Serumproben einzelner Tiere durchzuführen.
2.3. Komplementbindungsreaktion (BR)
2.3.1. Das Antigen entspricht einer Bakteriensuspension in Phenol-Kochsalzlösung (NaCl mit einer Massenkonzentration von 0,85 %, Phenol mit einer Volumenkonzentration von 0,5 %) oder in Veronalpuffer. Antigene können in konzentrierter Form abgegeben werden, vorausgesetzt, der anzuwendende Verdünnungsfaktor ist auf dem Flaschenetikett angegeben. Das Antigen ist bei 2 °C zu lagern und darf nicht eingefroren werden.
2.3.2. Seren sind wie folgt zu inaktivieren:
2.3.3. Im Interesse einer aussagekräftigen Testreaktion wird eine Kompletmentdosis verwendet, die höher ist als die für die komplette Hämolyse erforderliche Mindestdosis.
2.3.4. Bei jedem Reaktionstest sind folgende Funktionskontrollen durchzuführen:
2.3.5.Ergebnisberechnung
Das OHEIMS enthält 1.000 internationale KBR-Einheiten (IKBRE) je ml. Wird das OHEIMS nach einer gegebenen Methode getestet, so wird das Testergebnis als Bitterkeit (TOHEIMS; höchste direkte Verdünnung, die eine 50 %iger Hämolyse herbeiführt) ausgedrückt. Das als Bitterkeit vorliegende Testergebnis für das Testserum (TTESTSERUM ) ist als IKBRE je ml auszudrücken. Um einen Biter eines nach dieser Methode getesteten unbekannten Testserums (TTESTSERUM ) in den IKBRE-Wert umzurechnen (Faktor F), ist nach folgender Formel zu verfahren:
F = 1.000 × 1/TOHEIMS
Der Gehalt an internationalen KBR-Einheiten je ml Testserum (IK-BRETESTSERUM ) ist nach folgender Formel zu berechnen:
ICFTUTESTSERUM = F × TTESTSERUM
2.3.6.Ergebnisauswertung
Ein Serum mit 20 oder mehr IKBRE je ml gilt als positiv.
2.4. Milch-Ring-Test (MRT)
2.4.1. Das Antigen entspricht einer mit Haematoxylin angefärbten Bakteriensuspension in Phenol-Kochsalzlösung (NaCl mit einer Massenkonzentration von 0,85 %, Phenol mit einer Volumenkonzentration von 0,5 %). Das Antigen ist bei 2 °C zu lagern und darf nicht eingefroren werden.
2.4.2. Die Antigenempfindlichkeit ist im Verhältnis zum OHEIMS so zu standdrainieren, dass das Antigen bei einer 1:500-Verdünnung des OHEIMS in negativer Milch positiv und bei einer 1:1 000-Verdünnung negativ reagiert.
2.4.3. Der MRT ist an Proben durchzuführen, die für den Inhalt jeder Milchkannte bzw. jedes Sammeltanks des betreffenden Betriebs repräsentativ sind.
2.4.4. Die Milchproben dürfen weder eingefroren noch erhitzt noch heftig geschüttelt worden sein.
2.4.5. Der Test ist nach einer der folgenden Methoden durchzuführen:
2.4.6. Das Milch-Antigen-Gemisch ist zusammen mit positiven und negativ Even Arbeitsstandards für 50 Minuten bei 37 °C zu intubieren. Eine anschließende Inkubation während 15 bis 22 Stunden bei 2 °C erhöht die Testempfindlichkeit.
2.4.7. Ergebnisauswertung
2.5. Gepfefferter Brucella-Antigen-Test (Rose-Bengal-Test (ERBT))
2.5.1. Das Brucella-Antigen entspricht einer mit Bengalrosa angefärbten BackBakteriensuspension in Verdünnungspuffer mit einem pH-Wert von 3,55 ± 0,05. Das Antigen wird gebrauchsfertig geliefert. Es ist bei 2 °C zu lagern und darf nicht eingefroren werden.
2.5.2. Das Antigen wird ohne Bezug zur Zellenkonzentration hergestellt. Seine Empfindlichkeit muss jedoch im Verhältnis zum OHEIMS so standardisiert werden, dass es bei einer Serumverdünnung von 1:25 positiv und bei einer Serumverdünnung von 1:55 negativ reagiert.
2.5.3. Der ERBT ist wie folgt durchzuführen:
2.5.4.Ergebnisauswertung
Jede sichtbare Reaktion gilt als positiv, es sei denn, die Ränder sind stark angetrocknet.
Positive und negative Arbeitsstandards sind in jede Testreihe einzubeziehen.
2.6. Serumagglutinationstest (SAT)
2.6.1 Das Antigen entspricht einer Bakteriensuspension in Phenol-Kochsalzlösung (NaCl mit einer Massenkonzentration von 0,85 %, Phenol mit einer Volumenkonzentration von 0,5 %).
Formaldehyd darf nicht verwendet werden.
Antigene können in konzentrierter Form abgegeben werden, vorausgesetzt, der anzuwendende Verdünnungsfaktor ist auf dem Flaschenetikett angegeben.
Damit die Zahl falschpositiver Testergebnisse reduziert wird, kann der Bakteriensuspension in der Endverdünnung bis zu 5 WM EDTa zugesetzt werden. Der pH-Wert von 7,2 ist anschließend in der Antigensuspension neu anzupassen.
2.6.2. Das OHEIMS enthält 1.000 internationale Agglutinationseinheiten.
2.6.3. Das Antigen wird ohne Bezug auf die Zellenkonzentration aufbereitet; seine Empfindlichkeit ist jedoch im Verhältnis zum OHEIMS so zu standardisieren, dass entweder 50 % Agglutination mit einer Serum-Endverdünnung zwischen 1:500 und 1:1 000 oder 75 % Agglutination mit einer Serum-Endverdünnung zwischen 1:500 und 1:750 gewährleistet ist.
Es kann sich auch als sinnvoll erweisen, anhand einer Gruppe definierter Seren die Inaktivität neuer Antigenchargen mit bereits standardisierten Chargen zu vergleichen.
2.6.4. Der Test wird entweder in Reagenzgläsern oder auf Serotiterplatten durchgeführt. Die Mischung aus Antigen und Serumverdünnungen wird bei 37 °C für 15 bis 22 Stunden intubiert.
Für jedes Serum sind mindestens drei Verdünnungen anzulegen. Verdächtiges Serum ist so zu verdünnen, dass die im positiven Limit liegende Reaktion am mittleren Glas (beziehungsweise an der mittleren Vertiefung im Falle von Serotiterplatten) abgelesen wird.
2.6.5. Ergebnisauswertung
Die Stärke der Brucella-Agglutination im Serum ist als IE je ml auszudrücken.
Ein Serum mit mehr als 30 IE je ml gilt als positiv.
2.7. Fluoreszenz-Polarisations-Assay (FPA)
2.7.1 Der FPa kann in Reagenzgläsern oder auf Platten mit 95 Vertiefungen durchgeführt werden. Die angewendete Methode, ihre Standardisierung und die Auswertung der Testbefunde müssen den Vorgaben von Kapitel 2.2.3 (brucellosefreien) des OIE-Handbuchs zu Untersuchungsmethoden und Vakzinen für Landtiere, sechste Ausgabe (2008), entsprechen.
2.7.2.Teststandardisierung
Standardisierung des FPA:
Jede Testserie hat Folgendes zu beinhalten: ein starkpositives, ein schwachpositives und ein negatives Standardserum (kalibriert anhand der OIE-ELISA-Standardseren).
3. Ergänzende Testmethoden
3.1. Intrakutanes (BruDellintest)
3.1.1.Bedingungen für die Durchführung des Intrakutanes:
3.1.2. Der Test ist mit einem standardisierten und definierten Brucellin-Präparat durchzuführen, das kein Lipopolysaccharid-Antigen (LPS-Antigen)) der S-Form enthält, welches unspezifische Entzündungsreaktionen hervorrufen oder spätere serologische Untersuchungen beeinträchtigen kann.
Die Methode zur Herstellung von Brucellin muss den Vorgaben des Kapitels 2.2.3 Abschnitt C1 des OIE-Handbuchs zu Untersuchungsmethoden und Vakzinen für Landtiere, sechste Ausgabe (2008), entsprechen.
3.1.3.Testmethode
3.1.3.1. 0,1 ml Brucellin wird intrakutan in die Schwanzfalte, die Flankenhaut oder die Halsseite injiziert.
3.1.3.2 Das Testergebnis ist nach 28 bis 72 Stunden abzulesen.
3.1.3.3. Die Hautdicke an der Injektionsstelle vor der Injektion und bei der Nachuntersuchung wird mit Hilfe eines Mess-Schiebers mit Feineinstellung gemessen.
3.1.3.4.Ergebnisauswertung
Heftige Reaktionen manifestieren sich durch lokale Schwellung und Induration und sind leicht erkennbar.
Eine Hautverdickung von 1,5 bis 2 mm gilt als positiver Testbefund.
3.2. Kompetitiver Enzymimmunoassay (DELISA)
3.2.1.Bedingungen für die Anwendung des DELISA
Zur Bescheinigung der Brucellosefreiheit für den innergemeinschaftlichen Handel darf der DELISa nicht verwendet werden.
Rinder, die auf eine der anderen in diesem Anhang genannten serologische Untersuchungen positiv reagiert haben, können einem DELISa unterzogen werden, damit die anderen serologischen Testbefunde untermauert werden, insbesondere wenn in brucellosefreien oder amtlich anerkannt brucellosefreien Rinderbeständen eine Kreuzreaktion mit Antikörpern gegen andere Bakterien nicht ausgeschlossen werden kann, oder damit Reaktionen aufgrund von Restantikörpern ausgeschlossen werden, die sich wegen einer Impfung mit S19 gebildet haben.
3.2.2.Testmethode
Der Test ist in Übereinstimmung mit den Vorschriften des Kapitels 2.2.3 Abschnitt B Nummer 2 des OIE-Handbuchs zu Untersuchungsmethoden und Vakzinen für Landtiere, sechste Ausgabe (2008), durchzuführen.
4. Nationale Referenzenlaboratorien
4.1. Aufgaben und Befugnisse
Gemäß Artikel 5a benannte nationale Referenzlaboratorien sind zuständig für
| Anhang D |
Kapitel I
Amtlich anerkannt leukosefreie Bestände, Mitgliedstaaten und Gebiete
A. Ein Bestand gilt als amtlich anerkannt frei von enzootische Rinderleukose, wenn folgende Anforderungen erfüllt sind:
B. Der Status der amtlich anerkannten leukosefreien eines Bestandes bleibt erhalten, wenn folgende Voraussetzungen erfüllt sind:
C. Der Status der amtlich anerkannten leukosefreien eines Bestands wird ausgesetzt, wenn die Anforderungen gemäß Abschnitt B nicht erfüllt sind oder wenn aufgrund von Labortests oder klinischer Anzeichen bei einem oder mehreren Tieren Verdacht auf Leukose besteht und das (die) betreffenden) Tiere) unverzüglich geschlachtet wird (werden).
D. Der Status bleibt ausgesetzt, bis folgende Anforderungen erfüllt sind:
Die zuständige Behörde kann jedoch eine Ausnahme von der Verpflichtung, das Kalb einer infizierten Kuh zu schlachten, gewähren, wenn das Kalb unmittelbar nach seiner Geburt von der Mutter abgesondert wurde. In diesem Fall ist das Kalb an die Anforderungen gemäß Nummer 2 Ziffer iii) gebunden.
Die zuständige Behörde kann jedoch eine Ausnahme von der Verpflichtung, das Kalb einer infizierten Kuh zu töten, gewähren, wenn das Kalb unmittelbar nach seiner Geburt von der Mutter abgesondert wurde. In diesem Fall ist das Kalb an die Anforderungen gemäß Nummer 2 Ziffer iii) gebunden.
E. Nach dem Verfahren des Artikels 17 kann auf der Grundlage der gemäß Artikel 8 gemachten Angaben bestimmt werden, daß ein Mitgliedstaat oder ein Teil eines Mitgliedstaats als frei von enzootische Rinderleukose gilt, sofern folgende Anforderungen erfüllt sind:
oder
im Fall eines Mitgliedstaats: Alle über 22 Monate alten Tiere in mindestens 10 % der Bestände, nach dem Zufallsprinzip ausgewählt, sind in den letzten 22 Monaten nach Maßgabe von Kapitel II mit negativem Ergebnis getestet worden, und im Fall eines Teils eines Mitgliedstaats: Alle über 22 Monate alten Tiere sind in den letzten 22 Monaten nach Maßgabe von Kapitel II mit negativem Ergebnis getestet worden,
oder
F. Der Status der amtlich anerkannten leukosefreien eines Mitgliedstaats oder eines Gebiets eines Mitgliedstaats bleibt erhalten, wenn
G. Der Status der amtlich anerkannten leukosefreien eines Mitgliedstaats oder eines Teils eines Mitgliedstaats wird nach dem Verfahren des Artikels 17 ausgesetzt, wenn die Untersuchungen gemäß Abschnitt F erkennen lassen, daß sich die Seuchenlage in einem amtlich anerkannt leukosefreien Mitgliedstaat oder Teil eines Mitgliedstaats nachweislich wesentlich verändert hat.
Der Status der amtlich anerkannten leukosefreien kann nach dem Verfahren des Artikels 17 wiedererlangt werden, sofern die nach demselben Verfahren aufgestellten Anforderungen erfüllt sind.
Kapitel II
Tests zum Nachweis der enzootischen Rinderleukose
Die enzootische Rinderleukose (ERLE) wird nachgewiesen im Immunodiffusionstechnik nach Maßgabe der Bestimmungen gemäß den Abschnitten a und B oder im Enzymimmunoassay (ELISA) nach Maßgabe der Bestimmung gemäß Abschnitt C. Die Immunodiffusionstechnik kann nur im Einzeltest angewandt werden. Werden die Testergebnisse gerechtfertigterweise in Frage gestellt, so wird als zusätzliche Kontrolle ein Agar-Gel-Immundiffusionstest durchgeführt.
ALGID und ELISa werden anhand des E05-Serums standardisiert, das amtliches Standardserum der Union wird und bereitgestellt wird von:
Friedrich-Loeffler-Institut
Bundesforschungsinstitut für Tiergesundheit
OIE-Referenzlabor für Enzootische Bovine Leukose (EBL)
Südufer 10
17293 Greifswald - Insel Rieds
Deutschland
A. Agar-Gel-Immundiffusion zum Nachweis der enzootische Rinderleukose
Durchmesser der zentralen Vertiefung: 2 mm; Durchmesser der Randvertiefung: 5 mm;
Abstand zwischen zentraler Vertiefung und Randvertiefungen: 3 mm.
Bei fraglichen Ergebnissen kann der Test mit Konzentratserum wiederholt werden.
B. Verfahren der Antigenstandardisierung
1,6 %iger Agarose in TriseHCl-Puffer durch vorsichtiges Erhitzen auf 100 °C lösen. Lösung und die Rinderleukoseserum-Verdünnungen für etwa eine Stunde ins Wasserbad (55 °C) stellen.
15 ml der auf 55 °C erhitzten Agarose-Lösung mit den 15 ml Rinderleukoseserum, 1:10 verdünnt, mischen, kurz schütteln und jeweils 15 ml in zwei Petrischalen füllen. Das Verfahren mit dem 1:5 verdünnten Rinderleukoseserums wiederholen.
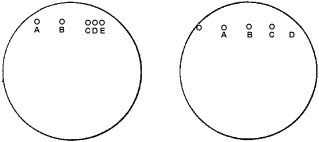
Agarose erstarren lassen, und wie folgt Löcher in das Agarose-Gel stanzen:
| Petrischale 1 Serum 1:10 |
Petrischale 2 Serum 1:10 |
 |
|
| Petrischale 3 Serum 1:5 |
Petrischale 4 Serum 1:5 |
 |
|
| Durchmesser in mm |
 |
| Verdünnungen der Antigene |
C. Enzymimmunoassay (ELISA) zum Nachweis der enzootischen Rinderleukose
Der ELISA-Test muss so empfindlich sein, dass das E05-Serum positiv reagiert, wenn es 10-mal (Serumproben) bzw. 250-mal (Milchproben) so stark verdünnt wird wie die Lösung, die sich aus der Zusammenfassung von Einzelproben in Pools ergibt. Bei Versuchen, in denen Proben (Serum und Milch) einzeln getestet werden, muss das im Verhältnis 1:10 (im Negativserum) oder 1:250 (in Negativmilch) verdünnte E05-Serum positiv reagieren, wenn es in derselben Verdünnung wie die Einzelproben
getestet wird. Die in Abschnitt a Nummer 2 angeführten amtlichen Institute sind für die Qualitätskontrollen des ELISA-Verfahrens zuständig und bestimmen insbesondere, wie viele Einzelproben aus jeder Produktionspartie auf der Grundlage des für das E05-Serum erhaltenen Biters in Pools zusammenzufassen sind.
| Anhang E(I) |
a) Rinderseuchen:
b) Schweineseuchen:
| Anhang E(II) |
| Anhang F 15 |
Muster 1 Tiergesundheitsbescheinigung für Zucht-eNutz-eSchlachtrinder
 |
 |
|
 |
 |
|
 |
 |
Muster 2 Tiergesundheitsbescheinigung für Zucht-/Nutz-eSchlachtschweine
 |
 |
|
 |
 |
|
 |
 |
ENDE |  |
(Stand: 18.07.2022)
Alle vollständigen Texte in der aktuellen Fassung im Jahresabonnement
Nutzungsgebühr: ab 105.- € netto
(derzeit ca. 7200 Titel s.Übersicht - keine Unterteilung in Fachbereiche)
Die Zugangskennung wird kurzfristig übermittelt
? Fragen ?
Abonnentenzugang/Volltextversion